
角膜移植免疫耐受的研究进展
15页1、角膜移植免疫耐受的研究进展【摘要】 排斥反应是角膜移植失败的主要原因。临床治疗中常用的非特异性免疫抑制剂,如糖皮质激素、环孢素A等,存在着许多全身副作用。因此诱导受体建立针对供体角膜的特异性免疫耐受是治疗排斥反应的理想方法。免疫耐受的机制主要包括T细胞克隆失活(anergy)、克隆清除(delete)、细胞因子介导的抑制及免疫平衡等。现就目前人工诱导免疫耐受的方法作一综述。 【关键词】 角膜移植免疫耐受Advancement of corneal transplantation immune tolerance AbstractCorneal transplantation is one of the most successful forms of organ transplantation in humans. However, immunologic rejection continues to be a common cause of graft failure. To obtain the long term survival of corneal grafts, espec
2、ially in high risk recipients, systemic immunosuppression such as cyclosporine A and dexamethasone are usually used in clinic. But these drugs have many undesirable side effects. So, it is necessary to search novel immunosuppression to induce antigen-specific tolerance. The immune tolerance mechanism includes the induction of specific T cell anergy, delete or immunoregulation. KEYWORDS: corneal transplantation; immune tolerance0 引言 排斥反应是角膜移植失败的主要原因1,2。现临床中常用的治疗药物如糖皮质激素、环孢素A等均为非特异性免疫抑制剂,同时抑制CD4+T
3、和CD8+T细胞,长期使用增加癌和感染的发生率。因此诱导受体产生针对供体角膜的特异性免疫耐受是解决排斥反应、短期用药即可使移植物长期存活的理想方法。免疫耐受的机制主要为T细胞克隆失活(anergy)、克隆清除(delete)、细胞因子介导的抑制及免疫平衡等。现就目前人工诱导免疫耐受的方法作一综述。 1阻断共刺激通路诱导免疫耐受 角膜移植排斥反应主要是由T淋巴细胞介导的迟发型超敏反应, CD4+T细胞是主要的效应细胞,其激活需要两种信号刺激,第一信号为特异性抗原识别信号,即CD4+T细胞表面的TCR-CD3复合体与抗原递呈细胞(APC)的抗原多肽-MHC类分子复合体结合,第二信号为共刺激信号,即APC表面黏附分子与CD4+细胞表面相应配体结合。如只有第一信号,缺乏共刺激信号的协同作用,接受抗原刺激的CD4+细胞不能有效活化,而处于特异性无反应状态(克隆失活),表现为免疫耐受。目前认为最重要的共刺激途径是B7-CD28/CTLA-4和CD40-CD154。 1.1 B7-CD28/CTLA-4共刺激途径 CD28与CTLA-4是一对正负调节性共刺激分子,各表达于100%的活化CD4+细胞表
4、面及活化24h后的CD4+细胞表面,竞争与APC表面的B7(CD80,CD86)分子结合。CD28与B7结合可导致CD4+细胞扩增、IL-2分泌、细胞周期蛋白表达上升、CD154表达上调;而CTLA-4与B7结合减少IL-2R表达及IL-2分泌,将细胞阻滞于G1期抑制其激活3。这一正负调节途径对于免疫动态平衡很重要。利用CTLA-4-B7负性共刺激信号及其竞争性阻断CD28-B7正性共刺激信号途径的作用,可诱导同种移植物的免疫耐受。CTLA-4Ig是由CTLA-4的细胞外功能区与人IgG1FC段融合形成的可溶性重组融合蛋白,是CTLA-4的功能性替代物。Comer等4在鼠角膜移植排斥模型中发现:无论是术前使用CTLA-4Ig浸泡供体还是术后使用CTLA-4Ig治疗受体,移植的角膜存活时间均明显延长。大量动物实验表明角膜移植术后,供受体接合区域有大量CD80(B7-1)及CD86(B7-2)的表达,联合应用抗CD80及抗CD86单克隆抗体,通过阻断CD28与B7结合可诱导免疫耐受,延长角膜同种异体移植物的存活时间5。 1.2CD40-CD154共刺激途径 特异性抗原识别信号可在4h后刺激
《角膜移植免疫耐受的研究进展》由会员人***分享,可在线阅读,更多相关《角膜移植免疫耐受的研究进展》请在金锄头文库上搜索。

开展矛盾纠纷大排查大调解专项活动总结

工地会议发言稿公路

食品安全工作总结格式版(4篇).doc

京东店铺全能运营技巧窍门

学业考试评价案例

《价格变动的影响》教学设计

易燃易爆物品和场所管理制度(四篇).doc

幼儿园中班户外活动方案计划方案模板(二篇).doc

财务个人实习总结范本(5篇).doc

高等职业教育硕士论文优秀范文

石台县食盐项目计划书【范文】
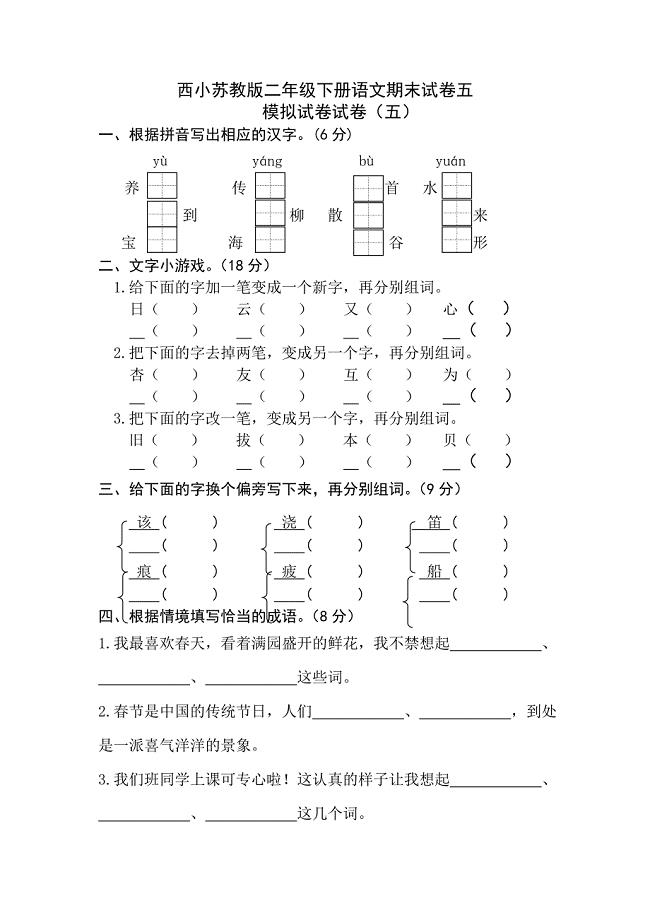
西小苏教版二年级下册语文期末试卷五

单位工作打架检讨书范文.doc

花卉与人类文明同行

2023年求职简历自我介绍合集15篇

葡萄酒庄可行性报告

工信局三送下乡帮扶工作总结范文

2023年采购助理工作总结(2篇).doc

护士转正的个人总结(4篇).doc

大力发展生态经济 加快建设美丽乡村
 新资产减值准则研究
新资产减值准则研究
2023-04-20 6页
 基于时频域介电响应的绝缘油弛豫过程分析
基于时频域介电响应的绝缘油弛豫过程分析
2023-06-20 10页
 河南省农业上市企业经营绩效优化思考
河南省农业上市企业经营绩效优化思考
2023-09-30 4页
 基坑支护及开挖专项施工方案(完整版)
基坑支护及开挖专项施工方案(完整版)
2023-03-02 18页
 绿色建筑设计中的BIM技术应用
绿色建筑设计中的BIM技术应用
2023-08-10 6页
 新时代国有企业行政管理改革研究
新时代国有企业行政管理改革研究
2022-09-15 4页
 《切线长定理》教学设计(最新整理)
《切线长定理》教学设计(最新整理)
2023-07-09 7页
 中国农业本土起源南大核心网
中国农业本土起源南大核心网
2023-04-25 10页
 在撰写学位论文或研究报告时必须遵守一定的学术性的
在撰写学位论文或研究报告时必须遵守一定的学术性的
2024-01-01 20页
 一般过去时,过去进行时和过去完成时精编版
一般过去时,过去进行时和过去完成时精编版
2023-03-05 4页
 2024年春江苏开放大学机械设计第3次作业答案
2024年春江苏开放大学机械设计第3次作业答案 2024年春江苏开放大学机器学习形考作业二答案
2024年春江苏开放大学机器学习形考作业二答案 2024年春江苏开放大学测试技术综合性大作业答案
2024年春江苏开放大学测试技术综合性大作业答案 2024年春江苏开放大学python程序设计形考作业1答案实验报告
2024年春江苏开放大学python程序设计形考作业1答案实验报告 2024春国开形势与政策大作业参考答案 二
2024春国开形势与政策大作业参考答案 二 2024年春季国家开放大学《形势与政策》形成性考核作业参考答案
2024年春季国家开放大学《形势与政策》形成性考核作业参考答案 2024春国开《教育法学》形考作业1至4试题
2024春国开《教育法学》形考作业1至4试题 国家开放大学2023秋《个人理财-厦门》大作业参考答案
国家开放大学2023秋《个人理财-厦门》大作业参考答案 国家开放大学《 生产与运作管理》形考任务1-5参考答案
国家开放大学《 生产与运作管理》形考任务1-5参考答案 2024年春国家开放大学《形势与政策》形考作业参考答案二
2024年春国家开放大学《形势与政策》形考作业参考答案二 2024年春国开《法治思想概论》形考作业参考答案
2024年春国开《法治思想概论》形考作业参考答案 国家开放大学《市场营销学》形考任务1-4参考答案
国家开放大学《市场营销学》形考任务1-4参考答案
