
体外诊断试剂临床研究相关要求
6页1、欢迎共阅体外诊断试剂临床研究相关技术要求北京培训记录内容以群中播报顺序为序,由于时间紧迫,没整理序号,反正是按序排列的,大家理解吧。本次主讲,针对通用的临床要求。但企业不要完全套用,今后审评三处将陆续推出诊断试剂的指导原则一、临床评审主要依据二、医疗器械临床试验规定,5号令三、体外诊断试剂注册管理办法(试行)(国食药监械2007229号)四、体外诊断试剂注册申报资料形式与基本要求的公告(国食药监械2007609号)体外诊断试剂临床研究技术指导原则(国食药监械2007240号)其他发布的指导原则本次课上主要讲解临床研究指导原则:包括临床研究基本原则、设计原则、报告撰写三个部分临床研究基本原则介绍临床研究,设计和管理是关键虽然该部分讲解缺少方案的撰写部分,但具体内容都体现在报告中了(报告和方案是对应的关系)设计和管理是临床试验的关键设计、管理、质量控制、过程监察、数据管理等等都是比较关键的(主讲总结)临床方案设计过程中,应以评审人员及产品未来上市角度对产品的评价需求及方法进行体现(乐爸总结)(资料中要体现出全面的内容)(一)基本要求1 .伦理考虑:虑临床研究用样本对受试者的风险性的程度是否
2、需要知情同意书剩余血液样本,对受试者无风险,并无法获得受试者知情同意,可以开伦理事宜的说明一一一般来说应该是伦理委员会提出,可以由牵头临床单位提出新鲜样本或必须有患者的直接取得的样本,必须通过伦理委员会的认可临床方案中,应对牵头单位及参与单位进行说明伦理事宜的说明一一盖伦理委员会的章伦理委员会对临床方案提供的意见,以及方案的修改情况应在注册申报资料中提出对研究对象信息保密,如:姓名、疾病情况等等临床前的研究结果支持进行临床研究研究单位及人员一一省级医疗卫生机构:许多药物临床基地不一定是省级医疗卫生机构省级:具有省级卫生医疗部门颁发的卫生医疗资质证明其它特殊情况:市级以上的疾控、专科医院、检验检疫所、戒毒中心II特殊产品:必须是特殊非常见或突发疾病或戒毒之类的产品,企业在选择时应确认该临床的特殊性人员要求:必须有相应的专业人员,并具有与研究相适应的仪器临床工作正式开始前:培训、预实验,熟悉方法、仪器及技术性能一一最大限度控制实验误差综合考虑地区,人种,流行病源背景,病原微生物的特性等因素,临床研究全过程,应吸收流行病学、统计学、临床医学、检验医学等方面的专业人员(或知识)以保证研究方法科
3、学合理临床前的预实验,可以保证正式临床工作的顺利推进和进行,以及结果的分析及统计(乐爸总结)(二)临床研究设计原则本次主要内容1、研究方法临床被考核试剂的批号应当与临床试验前申请人按照拟定产品标准做检测时所用样品批号一致,临床前的检测可以是自检报告,也可以是申请人的委托检测机构出具的检测报告不同包装规格时,可只采用一个包装规格进行临床一一仅限包装体积差异,其它完全无差异的情况。若成分差异则不作为不同包装规格,最好分开注册。即便如果要合并注册,临床也要分开欢迎共阅举例:胶体金,卡型和条型不同规格。需要进行临床对比验证;芯片,可以选择最全的规格进行临床1.1 新试剂:盲法同步,与金标准(病理组织学检查,手术发现,影响诊断,病原体分离培养,长期随访等)进行比较早期诊断,疗效检测,预后判断用途的,需进行跟踪研究研究对象选择:金标准确定未有某病的病例组+用金标准正式无该病的患者和正常人群的对照组(包括易与本病混淆的疾病组)病例组包括:症状:典型和非典型;病程:早中晚;病情:轻重中;病种:说明书预期用途中声称;还要考虑年龄,常见干扰(用药,代表性,常用药物,内源性物质等),交叉反应及易混病例,及无
4、病患者用药一一针对该疾病的常用或多用药物(常见药,常规药)病例需分布均匀合理、覆盖检测范围举例:肿瘤标志物内源性干扰:自身抗体,RF,结构类似物及其它标志物等巨细胞病毒:弓形虫,单纯疱疹等干扰研究方法可参考注册申报资料指导原则另有其他相关指导原则(征求意见稿或发布稿)一一已经发布的指导原则(肿瘤、血糖、流行性感冒病毒)在临床试验操作全过程和判定试验结果时,应采用盲法(尽可能双盲)是保证诊断实验结果的真实可靠的关键,强调盲法应贯彻在临床设计及实施全过程试验分组:随机盲法:单盲:病人不知道入组情况,研究者知道(亦带来研究者的主观偏倚);双盲:病人和研究者均不知应在临床方案中描述设盲方法,统计完成后揭盲临床试验中尽可能采用双盲方法,盲法实施确有困难的,则采取手段使偏移降低到最小一一比如,第三方统一数据管理及统计1.2 已有同品种批准上市产品的一一证明与已上市产品等效1)对比试剂考虑方法学,临床使用目的和范围,主要性能指标标准品或校准品溯源情况,推荐参考值等临床普遍认为较好方法学要求:原理一致同类产品,或原理一致灵敏度更优,样本类型不得超越对照试剂如无原理一致,可选择相近定量产品:参考值范围相
《体外诊断试剂临床研究相关要求》由会员大米分享,可在线阅读,更多相关《体外诊断试剂临床研究相关要求》请在金锄头文库上搜索。
![[最新]【北京课改版】七年级数学上册:1.11有效数字和科学记数法课堂导学含答案](https://union.152files.goldhoe.com/2023-5/10/b4475b6c-78a5-4407-8e2c-991d401d89c2/pic1.jpg)
[最新]【北京课改版】七年级数学上册:1.11有效数字和科学记数法课堂导学含答案

2022年二手房屋装修合同标准版范本
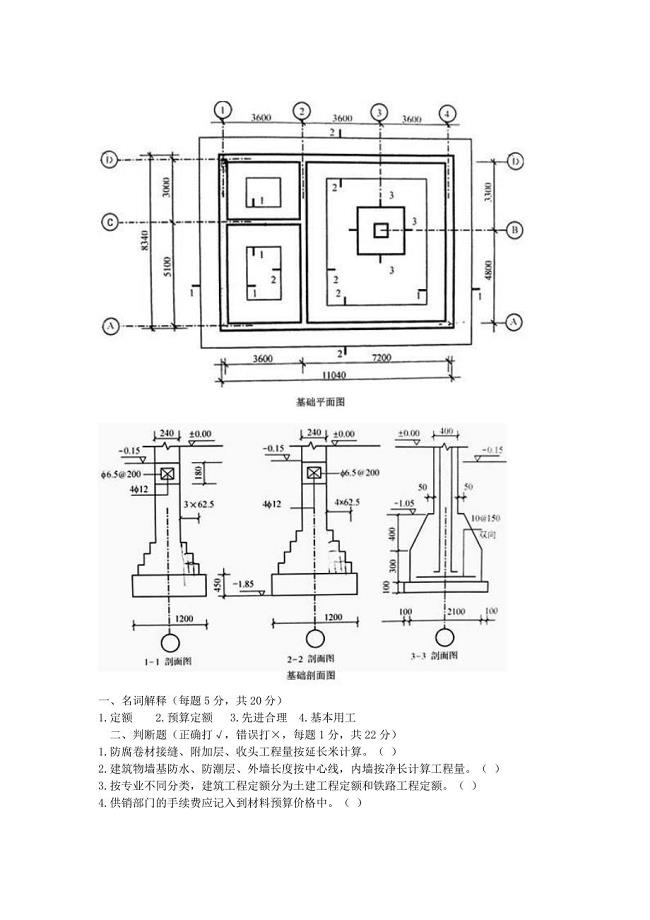
预算《排版》

安边镇学区二年级数学科导学稿1

学校安全工作计划15篇

部分中外数学家及其伟大的贡献

精密锻造模具项目建议书写作模板

地理信息系统概论课后习题部分答案

j盖梁帽梁耳墙施工方案

营业员个人工作计划格式版(四篇).doc

2022年投资股份合作协议书范本

【最新】宁夏银川市唐徕回民中学高三上学期10月月考地理试题含答案
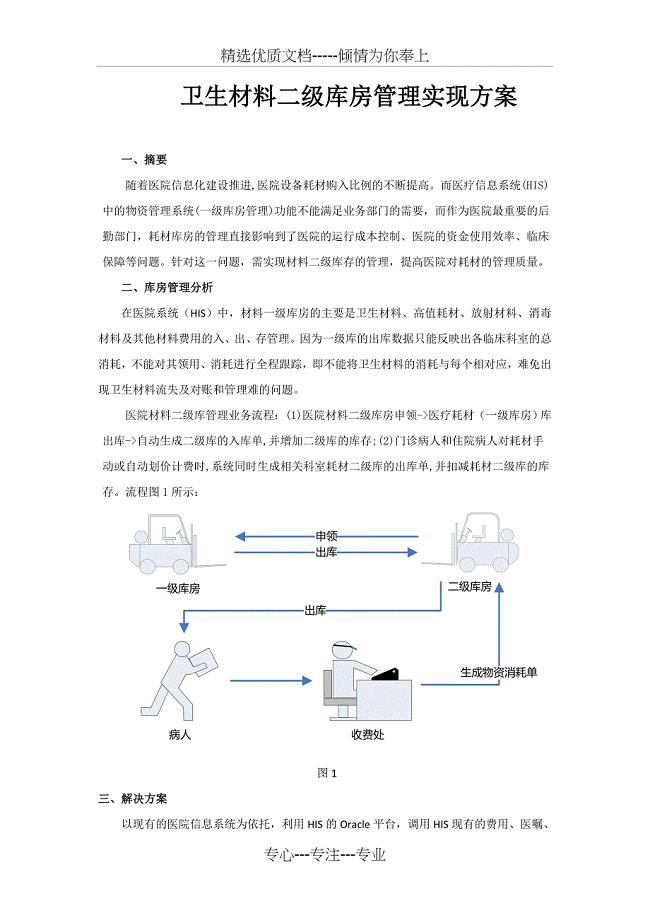
卫生材料二级库房管理实现方案

苏教版数学一年级上册教案统计

土地确权的基本内容

2对环境的感觉测试

残疾人康复中心建设项目建议书写作模板拿地立项备案

高聚氨酯保温板项目资金申请报告写作模板+定制代写

高中地理 第三章 自然资源的利用与保护单元综合测试卷 新人教版选修6

魅力女生美丽人生活动方案
 不同消毒方式对太湖原水出水水质影响的比较研究
不同消毒方式对太湖原水出水水质影响的比较研究
2023-08-03 2页
 公文管理制度
公文管理制度
2023-12-31 4页
 教学大纲与课程标准的区别
教学大纲与课程标准的区别
2023-05-10 9页
 信贷业务考试参考题
信贷业务考试参考题
2023-07-23 25页
 电压互感器相关知识汇总
电压互感器相关知识汇总
2023-01-09 22页
 管理人员安全培训试题及答案
管理人员安全培训试题及答案
2022-10-28 6页
 药品营销方案策划
药品营销方案策划
2022-08-27 6页
 宝鸡恒达鑫隆钢材销售合同
宝鸡恒达鑫隆钢材销售合同
2023-03-01 2页
 玻璃幕墙施工组织设计
玻璃幕墙施工组织设计
2023-11-13 37页
 直接引语改间接引语(宾语从句)练习
直接引语改间接引语(宾语从句)练习
2023-02-21 8页

