
【化学】同步微专题1元素及其化合物的性质及应用 2023-2024学年高一下人教版(2019)必修第二册
32页1、第五章化工生产中的重要非金属元素同步微专题1元素及其化合物的性质及应用1由点到面构建知识框架由点到面构建知识框架掌掌握握9种种核核心心物物质质的的性性质质及及应应用用,如如氯氯气气(Cl2,黄黄绿绿色色、刺刺激激性性、有有毒毒气气体体);二二氧氧化化硫硫(SO2,无无色色、刺刺激激性性、有有毒毒气气体体);氨氨气气(NH3,无无色色、刺刺激激性性气气体体);硫硫酸酸(H2SO4,高高沸沸点点、难难挥挥发发性性强强酸酸);硝硝酸酸(HNO3,无无色色、易易挥挥发发性性强强酸酸);二二氧氧化化硅硅(熔熔点点高高、硬硬度度大大、不不溶溶于于水水的的酸酸性性氧氧化化物物);碳碳酸酸钠钠(Na2CO3)和和碳碳酸酸氢氢钠钠(NaHCO3);铝铝的的化化合合物物;铁铁盐盐(含含Fe3+)和亚铁盐和亚铁盐(含含Fe2+)。2由由“共性共性”探探“个性个性”(1)常见单质的共性与个性常见单质的共性与个性金金属属单单质质共共性性在在金金属属活活动动性性顺顺序序表表中中,KNa能能与与冷冷水水反反应应;Mg与与热热水水反反应应;AlPb与与一一般般酸酸(H)反反应应生生成成H2;一一般般位位于于前前面面的
2、的金金属属在在水水溶溶液液中中能能把把位位于于后后面面的的金金属属从从其其盐盐中中置置换换出出来来;KAl的的冶冶炼炼可可用用电电解解法法,ZnCu可可用用热热还还原原法法冶冶炼炼,HgAg可用热分解法冶炼可用热分解法冶炼 金属金属单质单质个个性性Na在在常常温温下下与与空空气气反反应应生生成成Na2O,加加热热或或点点燃燃与与O2反反应应生生成成Na2O2;K、Ca、Na与与盐盐溶溶液液反反应应时时,先先与与H2O反反应应;Fe与与H2O(g)在在高高温温下下反反应应生生成成Fe3O4与与H2;Al既既可可与与酸酸反反应应,也也可可与与强强碱碱反反应应生生成成H2;Cu、Ag在在一一定定条条件件下下可可与与浓浓H2SO4或或HNO3反反应应生生成成SO2或或NOx;Fe、Al在在室室温温下下遇遇浓浓H2SO4、浓浓HNO3被钝化被钝化非非金金属属单单质质共共性性大大部部分分非非金金属属单单质质与与O2、H2反反应应生生成成氧氧化化物物、氢氢化化物物;大大部部分分非非金金属属单单质质与与金金属属可可以以化化合合;部部分分非非金金属属单单质质可可以以把把不不活活泼泼的非金属单质置换出来的
3、非金属单质置换出来个个性性H2在在加加热热条条件件下下可可以以还还原原一一些些金金属属氧氧化化物物(如如Fe2O3、CuO);Cl2可可以以与与H2O、NaOH等等反反应应;S可可以以与与NaOH、浓浓H2SO4、浓浓HNO3反反应应;N2与与O2反反应应需需要要放放电电或或高高温温条条件件且且生生成成NO;Si与与NaOH、HF反反应应;Cl2为为黄黄绿绿色色气气体体,Br2为为红红棕棕色色液液体体且且易易挥挥发发,I2为为紫紫黑黑色色固固体体且且易易升升华华,遇遇淀淀粉粉变变蓝蓝色色;Fe在在高高温温下与下与H2O(g)反应生成反应生成H2(2)常见氧化物的共性与个性常见氧化物的共性与个性金属氧化物的共性与个性金属氧化物的共性与个性a碱碱性性氧氧化化物物的的共共性性:与与酸酸反反应应生生成成盐盐和和水水;与与酸酸性性氧氧化化物物反反应应生成盐。生成盐。b个性个性化学式化学式Na2ONa2O2Al2O3FeOFe2O3CuO分类分类碱碱性性氧氧化化物物过氧化物过氧化物两两性性氧氧化化物物碱性氧化物碱性氧化物颜颜色状色状态态 白色固体白色固体 淡黄色固体淡黄色固体 白色固体白色固体 黑
4、色固体黑色固体红红棕棕色色粉末粉末黑色固体黑色固体化学式化学式Na2ONa2O2Al2O3FeOFe2O3CuO与与水水反反应应生成生成NaOH生生成成NaOH和和O2不溶于水,也不与水反应不溶于水,也不与水反应与与酸酸反反应应生生成成钠钠盐盐和和水水生生成成钠钠盐盐、水和水和O2生生成成铝铝盐盐和水和水生生成成亚亚铁铁盐和水盐和水生生成成铁铁盐和水盐和水生生成成铜铜盐和水盐和水氧化性氧化性除除Na2O2外外,氧氧化化性性很很弱弱,通通常常不不能用还原剂还原能用还原剂还原可可用用C、CO、Al、H2还还原生成单质铁、铜原生成单质铁、铜其其他他反反应应与与 CO2反反 应应生成生成Na2CO3与与CO2反反应应生生 成成 O2、Na2CO3与与强强碱碱反反应应生生成成偏偏铝酸盐铝酸盐与与氧氧化化性性酸酸反反应应生生成铁盐成铁盐非金属氧化物的共性与个性非金属氧化物的共性与个性a酸性氧化物的共性酸性氧化物的共性溶溶于于水水可可生生成成含含氧氧酸酸;与与碱碱反反应应生生成成盐盐和和水水;与与碱碱性性氧氧化化物物反反应应生生成盐。成盐。b个性个性SO2SO2的漂白性,使品红褪色,但加热又可恢复红
5、色的漂白性,使品红褪色,但加热又可恢复红色SO2的还原性:使溴水、氯水、碘水、酸性的还原性:使溴水、氯水、碘水、酸性KMnO4溶液褪色溶液褪色SO2的氧化性:通入的氧化性:通入H2S溶液中有淡黄色沉淀溶液中有淡黄色沉淀S生成生成NO2与与H2O反应生成反应生成HNO3和和NO,不是酸性氧化物,不是酸性氧化物NO2为红棕色气体,与为红棕色气体,与N2O4存在转化:存在转化:2NO2 N2O4与与NaOH反应生成反应生成NaNO3和和NaNO2,可用碱液吸收,可用碱液吸收NO无色不溶于水的气体无色不溶于水的气体遇遇O2变红棕色,生成变红棕色,生成NO2CO还原性、可燃性气体,可还原一些金属氧化物还原性、可燃性气体,可还原一些金属氧化物CO与血红蛋白结合使人体中毒与血红蛋白结合使人体中毒SiO2不溶于水的酸性氧化物不溶于水的酸性氧化物与与C高温下可制粗硅高温下可制粗硅与氢氟酸反应生成与氢氟酸反应生成SiF4气体,可用氢氟酸刻蚀玻璃气体,可用氢氟酸刻蚀玻璃P2O5H3PO4的酸酐,易吸水,可作干燥剂,但不能干燥的酸酐,易吸水,可作干燥剂,但不能干燥NH3(3)常见酸的共性与个性常见酸的共性与个
《【化学】同步微专题1元素及其化合物的性质及应用 2023-2024学年高一下人教版(2019)必修第二册》由会员s****6分享,可在线阅读,更多相关《【化学】同步微专题1元素及其化合物的性质及应用 2023-2024学年高一下人教版(2019)必修第二册》请在金锄头文库上搜索。

【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册

【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

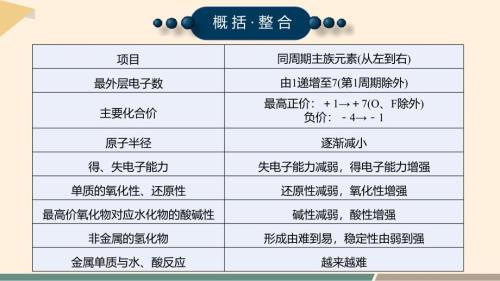
【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
【化学】能量转化的应用——化学电池课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学键与物质构成课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

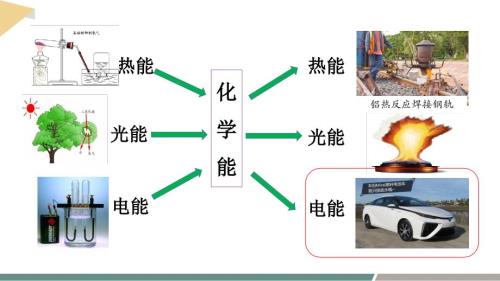
【化学】化学反应与能量转化 化学能与热能课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的限度课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的快慢课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】分子间作用力课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修2

【化学】电极方程式书写课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【地理】服务业区位因素及其变化 教学设计2023-2024学年高中地理人教版(2019)必修二

【化学】盐化肥检测题-2023-2024学年九年级化学人教版下册

【化学】金属和金属材料测试题----2023-2024学年九年级化学人教版下册
 【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 47页
 【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 27页
 【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册
【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册
2024-05-21 44页
 【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
2024-05-21 19页
 【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
2024-05-21 19页
 【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 22页
 【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
2024-05-21 17页
 【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 41页
 【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 36页
 【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
2024-05-21 39页

