
药事管理学整理知识点(兜兜版)(共13页)
13页1、精选优质文档-倾情为你奉上第一章1.药事的概念药事:指与药品的研制、生产、流通、使用、价格、广告、信息、监督等活动有关的事。2.药事管理的概念药事管理:是指国家对药学事业的综合管理,是运用管理学、法学、社会学、经济学等的原理和方法对药事活动进行研究,总结其规律,并用以指导药事工作健康发展的社会活动。3.药事管理学科的定义、性质;定义:是应用社会学、法学、经济学、管理学与行为科学等多学科的理论与方法,研究“药事”的管理活动及其规律的学科体系,是以药品质量监督管理为重点、解决公众用药问题为导向的应用学科,具有社会科学性质。性质:是药学的重要组成部分,是药学与社会学、法学、经济学、管理科学和心理学等学科相互交叉、渗透而形成的管理学科,是现代药学科学和药学实践的重要基础,是药学生的必修专业课,是国家执业药师考试的主要课目。4.药事管理学课程的内容。药品与药品监督管理 ;药事组织;药学技术人员管理;药品管理立法;药品注册管理;特殊管理的药品;中药管理;药品信息管理;药品知识产权保护;药品生产、经营管理以及医疗机构药事管理。第二章1.药品管理立法的概念 药品管理立法是指由特定的国家机关,依据法定的
2、权限和程序,制定、 认可、 修订、补充和废除药品管理法律规范的活动。2.我国药事法的渊源宪法;法律:中华人民共和国国家主席签署主席令公布;行政法规:中华人民共和国国务院公布地方性法规:省、自治区、直辖市人大及其常委会部门规章:国务院各部、委员国际条约地方性法规和地方性规章规范性文件3.药品管理法及其药品管理法实施条例的主要内容(1) 、开办药品生产企业的条件具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人;具有与具其药品生产相适应的厂房、设施和卫生环境;具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的一起设备;具有保证药品质量的规章制度。(2)、假药、劣药假药:药品所含成分与国家药品标准规定的成分不符的;以非药品冒充药品或者以其他种药品冒充此种药品的。(假成不符,冒充原料,未批污染,功超范围,禁用)有下列情形之一的药品,按假药论处:国务院药品监督管理部门规定禁止使用的;依照本法必须批准而未经批准生产、进口或者依照本法必须检验而未经检验即销售的;变质的;被污染的;使用依照本法必须取得批准文号而未取得批准文号的原料生产的;所标明的适应症或者功能主治超出规定范围
3、的。劣药:指药品成分的含量不符合国家药品标准的。(劣量,不符期批,包材容量未批,擅加香蕉肤色)有下列情形之一的药品,按劣药论处:未标明有效期或者更改有效期的;不注明或更改生产批号的;超过有效期的;直接接触药品的包装材料和容器未经批准的;擅自添加着色剂、防腐剂、香料、矫味剂及辅料的;其他不符合药品标准规定的。第三章1.药品的概念药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应证或者功能主治、用法和用量的物质。(包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等。)2.分类依据原则:安全性、有效性按照品种、规格、适应症、剂量、给药途径的不同,分为处方药与非处方药非处方药,根据安全性,分为甲类非处方、乙类非处方3.药品管理分类处方药与非处方药4.药品的质量特性药品质量特性是指药品与满足预防.治疗、诊断人的疾病,有目的地调节人的生理机能的要求有关的固有特性。药品的质量特性主要表现有效性(基本特征)、安全性(基本特征)、均一性(重要特征)、稳定性(重要特征)。5.药品监督管理的概念药品监督管理是指国家授权的行
4、政机关,依法对药品、药事组织、药事活动、药品信息进行管理和监督:另外,也包括司法、检察机关和药事法人及非法人组织、 自然人对管理药品的行政机关和公务人员的监督。6.药品标准的含义药品标准是指国家对药品的质量规格及检验方法所作的技术规定,是药品的生产、供应、使用、检验及监督管理部门共同遵循的法定依据。国家药品标准是指中华人民共和国药典、国家食品药品监督管理局批准的药品注册标准和其他药品标准。7.药品质量监督检验定义:是国家药品检验机构按照国家药品标准对需要进行质量监督的药品进行抽样、检查和验证并发出相关结果报告的药物分析活动。类型:抽查性检验、注册性检验、进出口药品检验性质:公正性、权威性、仲裁性8.处方药和非处方药的概念处方药是必须凭执业医师或执业助理医师处方才可调配、购买和使用的药品。非处方药是经专家遴选,由国家药品监督管理局批准并公布的药品,它不需凭执业医师或执业助理医师的处方,消费者可以自行判断购买和使用。9.非处方药物的遴选原则 应用安全、疗效确切、治疗稳定、使用方便10.处方药和非处方药分类管理及遴选、 生产、 经营、 广告和使用的具体规定P3911.药品不良反应、 严重药品
《药事管理学整理知识点(兜兜版)(共13页)》由会员桔****分享,可在线阅读,更多相关《药事管理学整理知识点(兜兜版)(共13页)》请在金锄头文库上搜索。

普通高等学校招生统一考试卷1(语文)

企业环保宣传标语2019

2022年初三下学期数学教师工作总结.doc

和道溪君别业温庭筠原文及解析

淄博CMOS图像传感器项目建议书

适合送领导的生日祝福语

白酒总代理合同范本2篇

老婆生日温馨祝福语

会计信息系统的结构分析
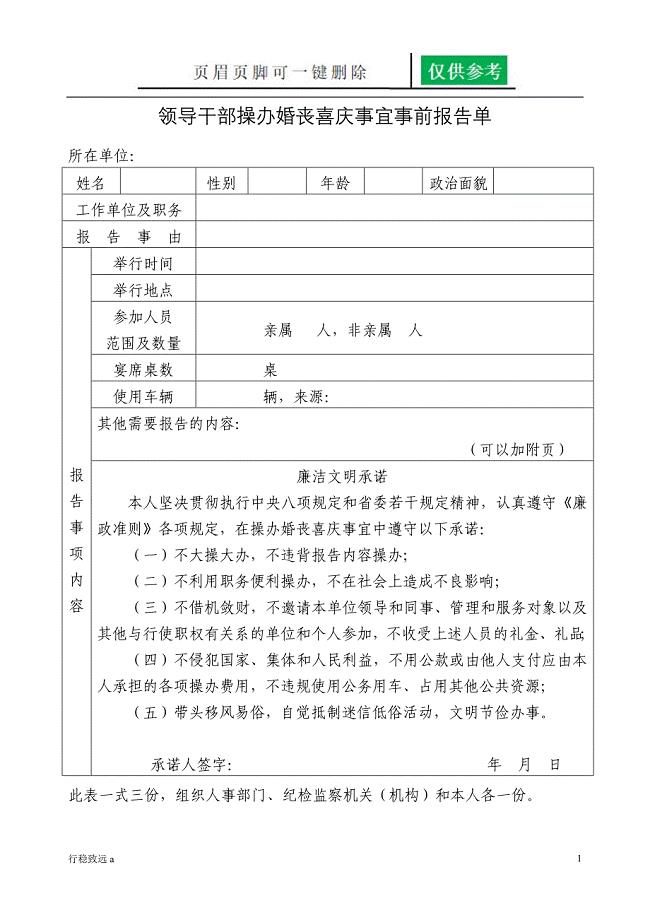
领导干部操办婚丧喜庆事宜报告单两报告一承诺向阳书屋

完成一款整机的流程

箱变安装流程

2023年电大英语词汇册2

join-in-新版四年级-Unit-2---In-the-classroom
![[电脑常用的30个操作小技巧知识总结介绍]iar常用快捷键和使用小技巧](https://union.152files.goldhoe.com/2022-10/3/e0ba8a91-85ed-453b-bea4-dfbcbc008891/pic1.jpg)
[电脑常用的30个操作小技巧知识总结介绍]iar常用快捷键和使用小技巧

国龙大厦营销推广策划案
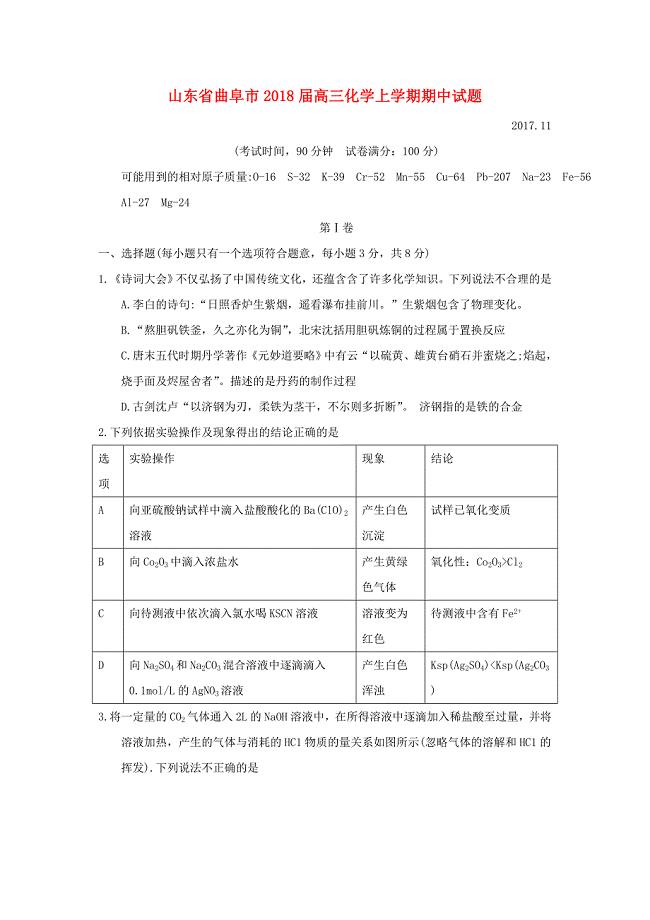
山东省曲阜市2018届高三化学上学期期中试题

有关历史和文化古迹保护的调查报告概要

艾滋病治疗方案

嘉峪关景区导游词
 join-in-新版四年级-Unit-2---In-the-classroom
join-in-新版四年级-Unit-2---In-the-classroom
2023-08-02 3页
 PEP五年级下册英语期末试卷带答案(共10页)
PEP五年级下册英语期末试卷带答案(共10页)
2023-07-22 10页
 施工资料全套材料包括的内容
施工资料全套材料包括的内容
2024-02-13 10页
 精选酒店下半年工作计划
精选酒店下半年工作计划
2023-11-21 10页
 办公室安全自查报告(DOC 22页)
办公室安全自查报告(DOC 22页)
2023-11-24 22页
 IATF16949中英文对照
IATF16949中英文对照
2023-05-07 89页
 最新工程施工课程设计11《某单层工业厂房施工组织设计书》
最新工程施工课程设计11《某单层工业厂房施工组织设计书》
2022-09-21 54页
 基于单片机的电子导盲杖设计(共32页)
基于单片机的电子导盲杖设计(共32页)
2023-05-29 33页
 模板脚手架施工作业指导书
模板脚手架施工作业指导书
2024-02-18 21页
 最新人教PEP版四年级上册英语《期中考试试卷》及答案解析(DOC 5页)
最新人教PEP版四年级上册英语《期中考试试卷》及答案解析(DOC 5页)
2023-12-10 5页

