
蛋白质相互作用
15页1、如果您需要使用本文档,请点击下载按钮下载!蛋白质相互作用的概述一、为什么要研究蛋白质相互作用二、蛋白质相互作用亲和力:Kd=AB/AB 三、蛋白质相互作用的应用 A、利用抗原和抗体的相互作用:Western blot,免疫共沉淀,染色质沉淀,抗体筛库 B、 利用已知的相互作用建立tag:GST pull down,BiotinAvidin结合, C、直接利用蛋白质的相互作用:蛋白质亲和层析,酵母双杂交,phage display,Bait蛋白质筛表达库,蛋白质组 四、相互作用的生物学意义:蛋白质间的相互作用是细胞生命活动的基础。 五、生物学功能的研究:获得功能或失去功能I、 一些常用蛋白质相互作用技术 Traditional co-purification (chromatography co-purification and co-sedimentation) Affinity chromatography:GST pull down ,Epitope-tag (co-)Immunoprecipitation Western和 Far-Western blotSurface Plas
2、mon ResonanceTwo-Hybrid System Fluorescence Resonance Energy Transfer (FRET)(实验过程及原理,注意事项,优缺点)III、研究实例讨论一、酵母双杂交系统 作用:发现新的相互作用蛋白质;鉴定和分析已有的蛋白质间的相互作用;确定蛋白质相互作用的功能基团具体过程:见书本优点:是酵母细胞的in vivo相互作用;只需要cDNA,简单;弱的相互作用也能检测到缺点:都是融合蛋白,万一融合出新的相互作用;酵母的翻译后修饰不尽相同,尤其是蛋白质的调控性修饰;自身激活报告基因;基因库德要求比较高,单向1/3是in frame蛋白质毒性;第三者Z插足介导的相互作用;假阳性酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启 动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列 化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三
3、杂交系统和反向杂交系统等。(1)原理:将编码某一蛋白X的DNA序列与DNA结合域BD的编码序列融合形成一个杂交体,将编码另一蛋白Y的DNA序列与DNA激活域AD的编码序列融合形成另一个杂交体,当两个杂交体共转化酵母细胞(此酵母细胞上游有DNA结合位点的报告基因),若X和Y没有相互作用,则单独不能激活报告基因的转录;若X和Y可相互作用,则使BD和AD靠近形成一个有效的转录激活子,激活报告基因的转录。因此可通过检测报告基因的转录来研究蛋白质X和Y的相互作用。 (2)应用范围1)已知蛋白之间相互作用的检测:2)蛋白质的功能域研究:通过对其中某一个蛋白质作缺失或定点突变,再用此系统检测是否还存在相互作用,可阐明其功能域或关键氨基酸;3)克隆新基因和新蛋白:将感兴趣的蛋白质基因与BD基因构建成“诱饵”表达质粒,将某一器官或组织的cDNA文库与AD基因构建成“猎物”基因库,共转化酵母细胞,可筛到与感兴趣蛋白质相互作用的蛋白质的cDNA序列,并推测其蛋白质序列。1) 二、噬茵体展示技术 在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱
4、上若含目的2 / 15如果您需要使用本文档,请点击下载按钮下载!蛋白, 就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择 性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞 系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。 三、等离子共振技术 表面等离子共振技术(SurfacePlasmonResonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用 一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是 不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。 四、荧光能量转移技术 (fluorescence resonance energy transfer,FRET)FRET:优点:体内测定两个蛋白质之间的相互作用;
《蛋白质相互作用》由会员鲁**分享,可在线阅读,更多相关《蛋白质相互作用》请在金锄头文库上搜索。

物业管理上半年工作计划(三篇).doc

世界经济概论试题及其答案及复习重点

外科一支部晋位升级工作总结

六一儿童节的祝福语集锦

工商职工爱岗敬业演讲稿(2篇)

数字应用篇丨数字能量如何应用于招聘

个人经营性贷款风险管理办法

牛津英语2BUnit1(4)

高考常见的作文名言

冲床自动送但料机构的设计

会计学 会计制度设计案例分析报告(1)
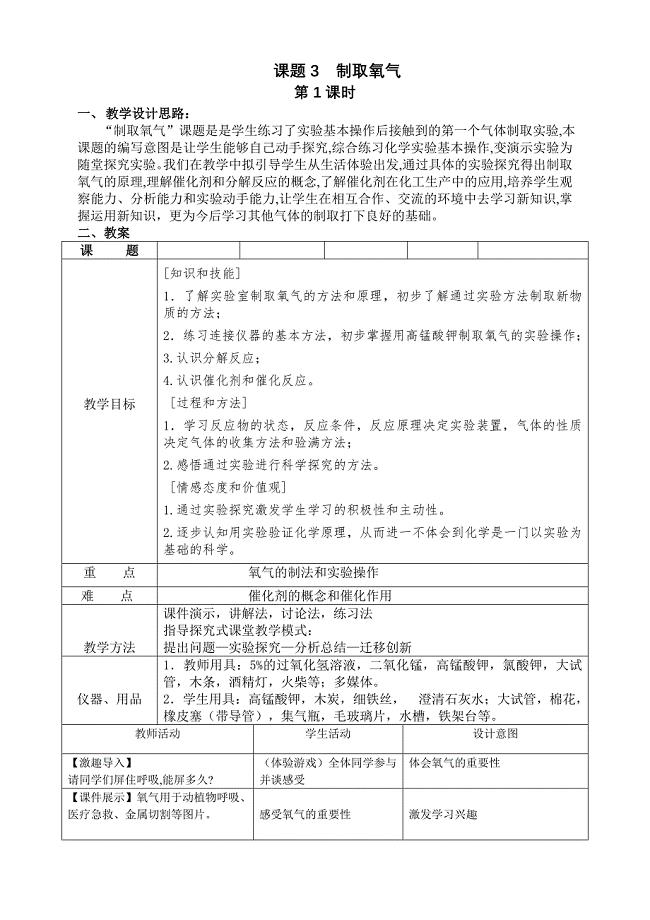
《制取氧气》教案

股票期权业务基础知识要点

35、119留守二期开班

北京师范大学21春《教育统计学》离线作业1辅导答案38

防火门合同书

小学新班主任工作计划例文(5篇)

小学音乐教学工作计划参考范文(四篇).doc

初中英语课外作业的创新设计

金平县制造业集群发展项目计划书
 外墙外保温结构一体化施工方案项目材料
外墙外保温结构一体化施工方案项目材料
2023-05-11 15页
 九年级数学上册第二章一元二次方程2.1认识一元二次方程第2课时一元二次方程根的估算同步练习版北师大版0830316
九年级数学上册第二章一元二次方程2.1认识一元二次方程第2课时一元二次方程根的估算同步练习版北师大版0830316
2023-05-14 5页
 建筑电气实习心得体会
建筑电气实习心得体会
2023-10-06 53页
 最新二年级数学上学期专项看图列式计算课堂知识加深练习题北京版
最新二年级数学上学期专项看图列式计算课堂知识加深练习题北京版
2022-07-30 5页
 PowerPoint幻灯片教学大纲修改
PowerPoint幻灯片教学大纲修改
2022-10-10 10页
 【最新教材】北师大版七年级下册:第二章平行线与相交线回顾与思考
【最新教材】北师大版七年级下册:第二章平行线与相交线回顾与思考
2024-01-04 6页
 江西省景德镇市高三第二次模拟文综试卷含答案
江西省景德镇市高三第二次模拟文综试卷含答案
2023-12-17 14页
 2022经纪人分类考试试题(难点和易错点剖析)含答案50
2022经纪人分类考试试题(难点和易错点剖析)含答案50
2023-10-20 4页
 苏教版二年级下学期数学单位知识点通用
苏教版二年级下学期数学单位知识点通用
2023-10-25 4页
 最新【人教版】四年级上册语文:电子作业鸟的天堂
最新【人教版】四年级上册语文:电子作业鸟的天堂
2023-02-18 4页

