
《医疗器械生产质量管理规范无菌医疗器械实施细则(试行)》
27页1、 .wd.医疗器械生产质量管理标准无菌医疗器械实施细则试行第一章总则第一条为了标准无菌医疗器械生产质量管理体系,根据?医疗器械生产质量管理标准?的要求,制定本实施细则。第二条本实施细则适用于第二类和第三类无菌医疗器械的设计开发、生产、销售和服务的全过程。本实施细则中的无菌医疗器械包括通过最终灭菌的方法或通过无菌加工技术使产品无任何存活微生物的医疗器械。第三条无菌医疗器械生产企业以下简称生产企业应当根据产品的特点,按照本实施细则的要求,建设质量管理体系,形成文件,加以实施并保持其有效性。作为质量管理体系的一个组成局部,生产企业应当在产品实现全过程中实施风险管理。第二章管理职责第四条生产企业应当建设相应的组织机构,规定各机构的职责、权限,明确质量管理职能。生产管理部门和质量管理部门负责人不得互相兼任。第五条生产企业负责人应当具有并履行以下职责:一组织制定生产企业的质量方针和质量目标;二组织筹划并确定产品实现过程,确保满足顾客要求;三确保质量管理体系有效运行所需的人力资源、根基设施和工作环境;四组织实施管理评审并保持记录;五指定专人和部门负责相关法律法规的收集,确保相应法律法规在生产企业内部
2、贯彻和执行。第六条生产企业负责人应当确定一名管理者代表。管理者代表负责建设、实施并保持质量管理体系,报告质量管理体系的运行情况和改良需求,提高员工满足法规和顾客要求的意识。第三章资源管理第七条生产、技术和质量管理部门的负责人应当熟悉医疗器械的法规、具有质量管理的实践经历,有能力对生产和质量管理中的实际问题作出正确的判断和处理。第八条从事影响产品质量工作的人员,应当经过相应技术和法规等培训,具有相关理论知识和实际操作技能。第九条生产企业应当具备并维护产品生产所需的生产场地、生产设备、监视和测量装置、仓储场地等根基设施以及工作环境。生产环境应当符合相关法规和技术标准的要求。第十条假设工作环境条件可能对产品质量产生不利影响,生产企业应当建设对工作环境条件要求的控制程序并形成文件或作业指导书,以监视和控制工作环境条件。第十一条生产企业应当有整洁的生产环境。厂区的地面、路面周围环境及运输等不应对无菌医疗器械的生产造成污染。行政区、生活区和辅助区的总体布局合理,不得对生产区有不良影响。厂址应当远离有污染的空气和水等污染源的区域。第十二条生产企业应当确定产品生产中防止污染、在相应级别干净室区内进展生
3、产的过程。空气干净级别不同的干净室区之间的静压差应大于5帕,干净室区与室外大气的静压差应大于10帕,并应有指示压差的装置。一样级别干净室间的压差梯度要合理。无菌医疗器械生产中干净室区的级别设置原那么见附录。第十三条干净室区应当按照无菌医疗器械的生产工艺流程及所要求的空气干净度级别进展合理布局。同一干净室区内或相邻干净室区间的生产操作不得互相穿插污染。干净室区的温度和相对湿度应当与产品生产工艺要求相适应。无特殊要求时,温度应当控制在1828,相对湿度控制在45%65%。第十四条生产厂房应当设置防尘、防止昆虫和其他动物进入的设施。干净室区的门、窗及安全门应当密闭。干净室区的内外表应当便于清洁,能耐受清洗和消毒。第十五条干净室区内使用的压缩空气等工艺用气均应经过净化处理。与产品使用外表直接接触的气体,其对产品的影响程度应当进展验证和控制,以适应所生产产品的要求。第十六条生产企业应当制定干净室区的卫生管理文件,按照规定对干净室区进展清洁、清洗和消毒,并作好记录。所用的消毒剂或消毒方法不得对设备、工艺装备、物料和产品造成污染。消毒剂品种应当定期更换,防止产生耐药菌株。第十七条生产企业应当对干净室
4、区的尘粒、浮游菌或沉降菌、换气次数或风速、静压差、温度和相对湿度进展定期检监测,并对初始污染菌和微粒污染是否影响产品质量进展定期检监测和验证,检监测结果应当记录存档。第十八条生产企业应当建设对人员安康的要求,并形成文件。应有人员安康档案。直接接触物料和产品的操作人员每年至少体检一次。患有传染性和感染性疾病的人员不得从事直接接触产品的工作。第十九条生产企业应当建设对人员服装的要求,并形成文件。生产企业应当制定干净和无菌工作服的管理规定。干净工作服和无菌工作服不得脱落纤维和颗粒性物质,无菌工作服应能包盖全部头发、胡须及脚部,并能阻留人体脱落物。第二十条生产企业应当建设对人员的清洁要求,并形成文件。无菌医疗器械生产企业应当制定干净室区工作人员卫生守那么。人员进入干净室区应当按照程序进展净化,并穿戴干净工作服、工作帽、口罩、工作鞋。裸手接触产品的操作人员每隔一定时间应对手再进展一次消毒。第二十一条生产企业应当确定所需要的工艺用水。当生产过程中使用工艺用水时,应当配备相应的制水设备,并有防止污染的措施,用量较大时应通过管道输送至干净区。工艺用水应当满足产品质量的要求。第二十二条生产企业应当制定工
《《医疗器械生产质量管理规范无菌医疗器械实施细则(试行)》》由会员re****.1分享,可在线阅读,更多相关《《医疗器械生产质量管理规范无菌医疗器械实施细则(试行)》》请在金锄头文库上搜索。

物业水电维修工作计划参考范文(四篇).doc

论以宿舍为基点开展大学生心理健康教育的重要性
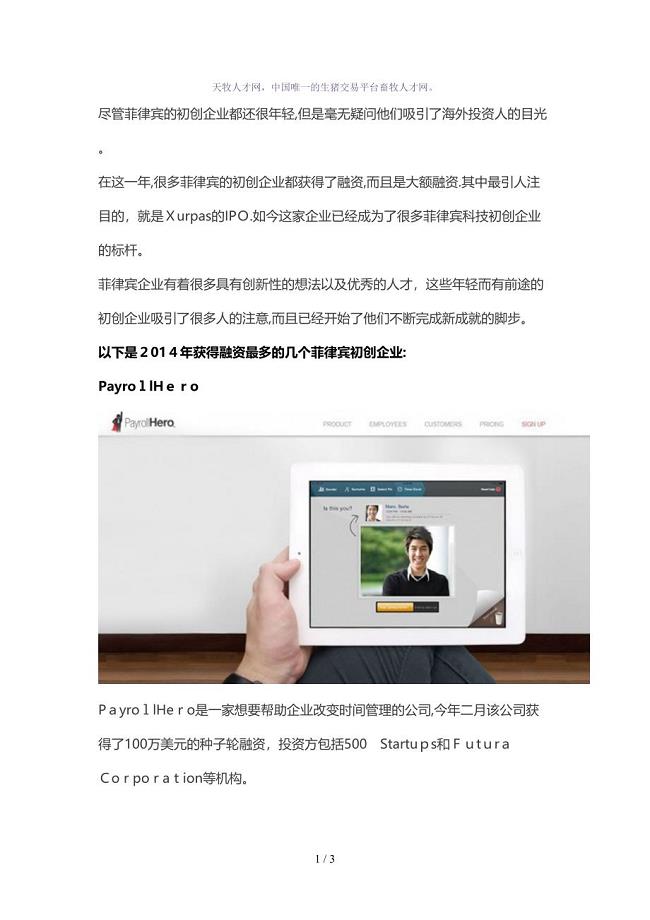
2014年菲律宾最高融资初创企业

镇江骨科植入物项目可行性研究报告(模板范文)

酒店预防传染病应急预案1

人类与地理环境的协调发展全章教案

学院消防安全检查工作计划(2篇).doc

鲁教版数学八上1.3公式法学案2

(转)走进新课标

2023年餐厅员工述职报告

2023年毕业晚会节主持稿(2篇)

口腔科医生个人工作总结范文

建设局建设新农村经验材料 (6)

班主任开学典礼发言稿

初一下数学第一章总结

5秋姑娘课时练习题及答案

中外来件装配合同(7篇).doc

精校版【北师大版】五年级上册数学单元测试卷全套18页Word版
部编人教版一年级语文下册期末试题全面

板蓝根颗粒提取生产工艺规程
 公司财务报销管理制度
公司财务报销管理制度
2022-12-03 10页
 酒店前台年终工作总结
酒店前台年终工作总结
2023-04-02 11页
 5-WO_103_C1 天线原理和选型-60
5-WO_103_C1 天线原理和选型-60
2022-12-12 60页
 河北油品添加剂项目可行性研究报告(DOC 92页)
河北油品添加剂项目可行性研究报告(DOC 92页)
2023-02-12 92页
 肿瘤内科英语单词
肿瘤内科英语单词
2022-07-13 12页
 教育专题:第二章合并同类项的反思性说课
教育专题:第二章合并同类项的反思性说课
2023-08-03 4页
 专题讲座资料(2021-2022年)沟通与协调能力
专题讲座资料(2021-2022年)沟通与协调能力
2022-12-02 9页
 人力资源薪资工具书
人力资源薪资工具书
2023-07-31 92页
 新《施工组织方案范文》桥梁钻孔桩施工
新《施工组织方案范文》桥梁钻孔桩施工
2023-12-24 5页
 矿厂运输队红旗手申报材料
矿厂运输队红旗手申报材料
2023-10-13 5页

