
补充申请要求
6页1、附件4:药品补充申请注册事项及申报资料要求一、注册事项(一)国家食品药品监督管理局审批的补充申请事项:1 .持有新药证书的药品生产企业申请该药品的批准文号。2 .使用药品商品名称。3 .增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应 症。4 .变更用法用量或者变更适用人群范围但不改变给药途径。5 .变更药品规格。6 .变更药品处方中已有药用要求的辅料。7 .改变影响药品质量的生产工艺。8 .修改药品注册标准。9 .替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。10 .进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触 药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。11 .申请药品组合包装。12 .新药的技术转让。13 .修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。14 .改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有 效期、包装规格等。15 .改变进口药品的产地。16 .改变进口药品的国外包装厂。17 .进口药品在中国国内分包装。18 .其他。(二)省级
2、食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监 督管理局直接备案的进口药品补充申请事项:19 .改变国内药品生产企业名称。20 .国内药品生产企业内部改变药品生产场地。21 .变更直接接触药品的包装材料或者容器(除上述第10事项外)。22 .改变国内生产药品的有效期。23 .改变进口药品制剂所用原料药的产地。24 .变更进口药品外观,但不改变药品标准的。25 .根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。26 .补充完善进口药品说明书安全性内容。27 .按规定变更进口药品包装标签。28 .改变进口药品注册代理机构。29 .其他。(三)省级食品药品监督管理部门备案的补充申请事项:30 .根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。31 .补充完善国内生产药品说明书安全性内容。32 .按规定变更国内生产药品包装标签。33 .变更国内生产药品的包装规格。34 .改变国内生产药品制剂的原料药产地。35 .变更国内生产药品外观,但不改变药品标准的。36 .其他。二、申报资料项目及其说明1 .药品批准证明文件及其附件的复印件:
3、包括与申请事项有关的本品各种批准文件,如药品注册批件、 补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、新药证书、进口药品注册证、医药产品注册证等。附件包括上述批件的附件,如药品标准、说明 书、标签样稿及其他附件。2 .证明性文件:(1)申请人是药品生产企业的,应当提供药品生产许可证及其变更记录页、营业 执照、药品生产质量管理规范认证证书复印件。申请人不是药品生产企业的,应当提供 其机构合法登记证明文件的复印件。由境外制药厂商常驻中国代表机构办理注册事务的,应当提供外国企业常驻中国代表机构登记证复印件。境外制药厂商委托中国药品注册代理机构代理申报的,应当提供委托文书、 公证文书及其中文译本,以及中国药品注册代理机构的营业执照复印件。(2)对于不同申请事项,应当按照“申报资料项目表”要求分别提供有关证明文件。(3)对于进口药品,应当提交其生产国家或者地区药品管理机构出具的允许药品变更 的证明文件、公证文书及其中文译本。其格式应当符合中药、天然药物、化学药品、生物制 品申报资料项目中对有关证明性文件的要求。除变更药品规格、改变产地、改变制药厂商和
4、注册地址名称外,生产国家或者地区药品管理机构不能出具有关证明文件的,可以依据当地法律法规的规定做出说明。3 .修订的药品说明书样稿,并附详细修订说明。4 .修订的药品标签样稿,并附详细修订说明。5 .药学研究资料:根据对注册事项的不同要求, 分别提供部分或全部药学研究试验资料和必要的原注册申 请相关资料,申报资料项目按照附件13中相应的申报资料项目提供。6 .药理毒理研究资料:根据对注册事项的不同要求,分别提供部分或全部药理毒理研究的试验资料和必要的国内外文献资料,申报资料项目按照附件13中相应的申报资料项目提供。7 .临床试验资料:要求进行临床试验的,应当按照附件13中相应的申报资料项目要求,在临床试验前后分别提交所需项目资料。不要求进行临床试验的,可提供有关的临床试验文献。持有新药证书的药品生产企业申请该药品的批准文号+一一一+*1一一使用药品商品名称+*2+一一一增加中药的功能主治或者化学药品、生物制品国内已 有批准的适应症+一+一#变更用法用量或者变更适用人群范围但不改变给药途 径+一+一#+一+一*3义更药品规格变更药品处方中已有药用要求的辅料+一+*4*4+改变影响药品质量
《补充申请要求》由会员hs****ma分享,可在线阅读,更多相关《补充申请要求》请在金锄头文库上搜索。
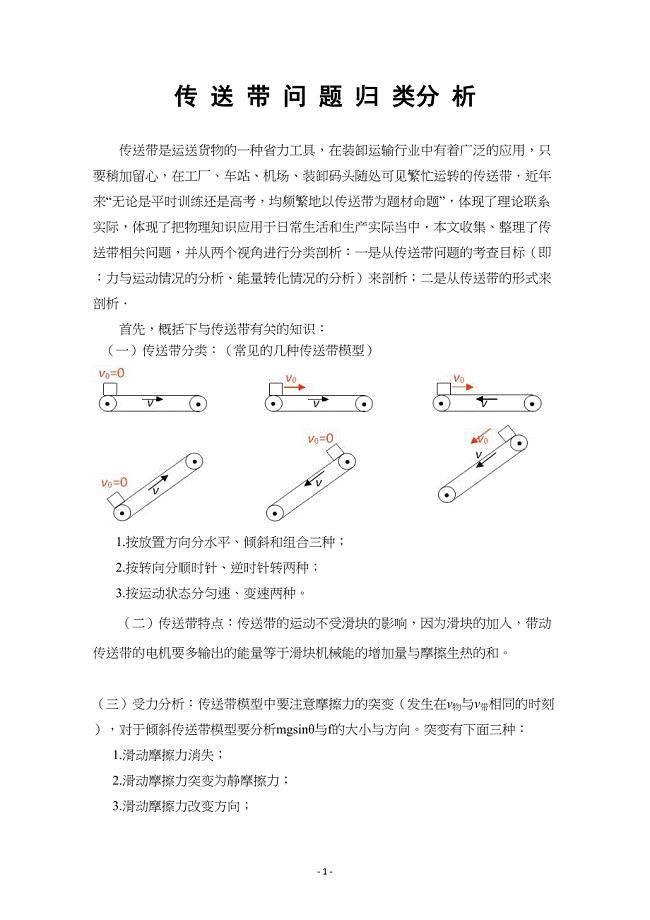
(完整版)传送带问题归类分析(DOC 18页)

山东省枣庄市峄城区吴林街道中学九年级语文上册10中国恢复对香港行使主权第一课时教案北师大版

2022年情人节活动策划方案合集八篇

四川省蓬安县八年级语文上册16大自然的语言第1课时导学案无答案新人教版

高中英语新课标外研版必修1教案(Module 6 5th period)

网上超市管理系统毕业论文

邀约话术

土木建筑专业词汇

小学课堂观察量表设计Word编辑

苏州市工业园区2021年中考数学模拟试卷4月含答案解析

数据结构复习要点

初一学生如何制定学习计划.doc

2021个人雇佣合同格式范本

创新和谐民政民生工作调研报告
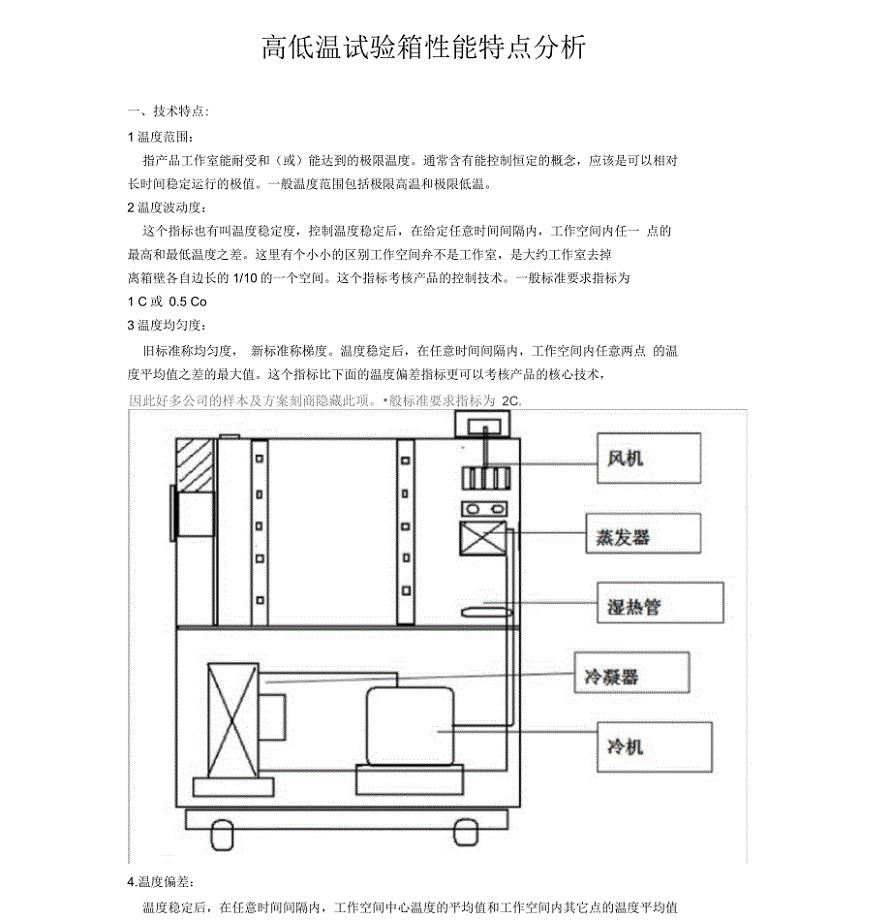
高低温试验箱性能特点分析

2023年小学二年级理想作文范文7篇

化学化工学院暑期社会实践总结

微型电机项目可行性研究报告-申请建议书用可修改样本

发改局2021年度工作总结汇报材料

教师教学反思总结样本(2篇).doc
 《石油加工工程》模拟试卷及答案
《石油加工工程》模拟试卷及答案
2022-11-11 14页
 护理管理学 试题与答案 第十二章 护理管理与医疗卫生法律法规
护理管理学 试题与答案 第十二章 护理管理与医疗卫生法律法规
2023-05-20 4页
 工资系统分析报告
工资系统分析报告
2022-09-02 14页
 百事:客户扣率管理经典剖析
百事:客户扣率管理经典剖析
2024-02-06 6页
 公务员转正考察材料
公务员转正考察材料
2023-02-19 2页
 毕业设计-无线通信技术热点及其发展趋势
毕业设计-无线通信技术热点及其发展趋势
2023-03-13 32页
 2019年中考数学复习第二部分热点专题突破专题五函数图象的变化试题含解析
2019年中考数学复习第二部分热点专题突破专题五函数图象的变化试题含解析
2023-10-14 16页
 25层安全施工方案kdh
25层安全施工方案kdh
2023-05-27 36页
 淘宝网店物资规范流程制度
淘宝网店物资规范流程制度
2022-09-24 7页
 高二物理必修期末考试试题
高二物理必修期末考试试题
2023-06-03 3页

