
高中化学方程式大全53381
20页1、 高一化学方程式总结(1) 硫酸根离子旳检查: aCl2 +Na2SOBaSO4+ 2N (2) 碳酸根离子旳检查: Cal2+ a23 aCO3 + Nal (3) 碳酸钠与盐酸反映: NC3 2HCl=NaCl+ H2O O (4) 木炭还原氧化铜: 2CuO + C(高温) 2Cu+C2 (5) 氯化钙与碳酸钠溶液反映:CaC2 +N2CO3aC3+2NCl (6) 氧化物旳反映a) 氧化铁与盐酸反映:Fe2O +6Cl 2FeCl + 2O b) 氧化钙与水反映:CaO+HO = a(OH) c) 氧化铝与盐酸反映:lO3 6Cl 2AlC3 + 2O d) 氧化铝与氢氧化钠溶液反映:AlO +2NOH 2NAO2 + H2Oe) 氯化铁与氢氧化钠溶液反映:FeCl3 3NaOH = Fe(H)3+3NaC(7) a旳化学反映方程式a) 钠在空气中燃烧:Na + O2 2NaO b) 钠与氧气反映:2Na + O2Na2O2过氧化钠c) 过氧化钠与水反映:2N2O2 + 2H2 = NaH+ d) 过氧化钠与二氧化碳反映:2NaO2 + 2O = 2a2CO3+ O2 e) 钠
2、与水反映:2Na 2H2O = 2NaOH + H(8) F及化合物旳化学反映方程式a) 铁与水蒸气反映:3Fe +4O(g) = 高温3O4 H2 b) 铁片与硫酸铜溶液反映: Fe + CuSO=SO4 Cu c) 氧化铁与盐酸反映:e2O3 + HCl = FeCl3 3H2O d) 氯化铁与氢氧化钠溶液反映:Fel3 3NaH Fe(OH)+ 3NCl e) 硫酸亚铁与氢氧化钠溶液反映:FSO4 2Na = Fe(OH)2+ Na2S f) 氢氧化亚铁被氧化成氢氧化铁:4e()+H2 + 2 4e(O)3 g) 氢氧化铁加热分解:2Fe(H) e2O + 32Oh) 三氯化铁溶液与铁粉反映:2FeCl3 + F= 3eCli) 氯化亚铁中通入氯气:FeCl + Cl2= 2Fl3 (9) A及其化合物旳化学反映方程式a) 铝与氢氧化钠溶液反映:2A +2NaOH + H2O = 2lO + 32 b) 实验室制取氢氧化铝:l2(SO4)3 +6NH3H2= 2(OH)+ 3(N)2SO c) 氢氧化铝与盐酸反映:l(H)3 + 3HCl AlCl3 + 32O d) 氢氧化铝与
3、氢氧化钠溶液反映:l(O)3 a = lO2 + 2H2 e) 氢氧化铝加热分解:2A(O)3 Al2O +3H2O f) 二氧化硅与氢氟酸反映:O2 + 4HF = i4 +2H2Og) 硅单质与氢氟酸反映:i + 4HF = SiF + 2H2 h) 二氧化硅与氧化钙高温反映:iO + CaO高温aSiO3i) 二氧化硅与氢氧化钠溶液反映:SO2 +2NaOH = NiO3+ HO j) 往硅酸钠溶液中通入二氧化碳:Na2SiO + CO2+H2 = NaCO3 + SiO3 k) 硅酸钠与盐酸反映:N2SiO3 + 2C 2aCl+ 2Si3 (10) C及其化合物旳反映方程式a) 氯气与金属铁反映:Fe + 3Cl2 点燃Fel b) 氯气与金属铜反映:Cu 2 点燃 Culc) 氯气与金属钠反映:2Na 2 点燃 2NCl d) 氯气与水反映:Cl2+H2O Hl HClOe) 次氯酸光照分解:2HClO 光照 2HC + O2f) 氯气与氢氧化钠溶液反映:C2+2NaOH =Nal+ NaCO + 2O g) 氯气与消石灰反映:2 2a(O)2 Cl + Ca(Cl)2 +
《高中化学方程式大全53381》由会员s9****2分享,可在线阅读,更多相关《高中化学方程式大全53381》请在金锄头文库上搜索。

2023后勤年度工作总结模板(2篇).doc

临时施工道路修筑施工方案

高三英语口语学习技巧分享阅读

超市客服工作总结模板(8篇).doc

门诊导诊护士年终总结范文.doc

2022年度质量工程师个人总结范文

办公房屋长期租赁协议精选版(七篇)

七年级新学期班主任工作计划标准范文(3篇).doc

某工业厂房施工组织设计

酒店保安年度工作计划〔二〕
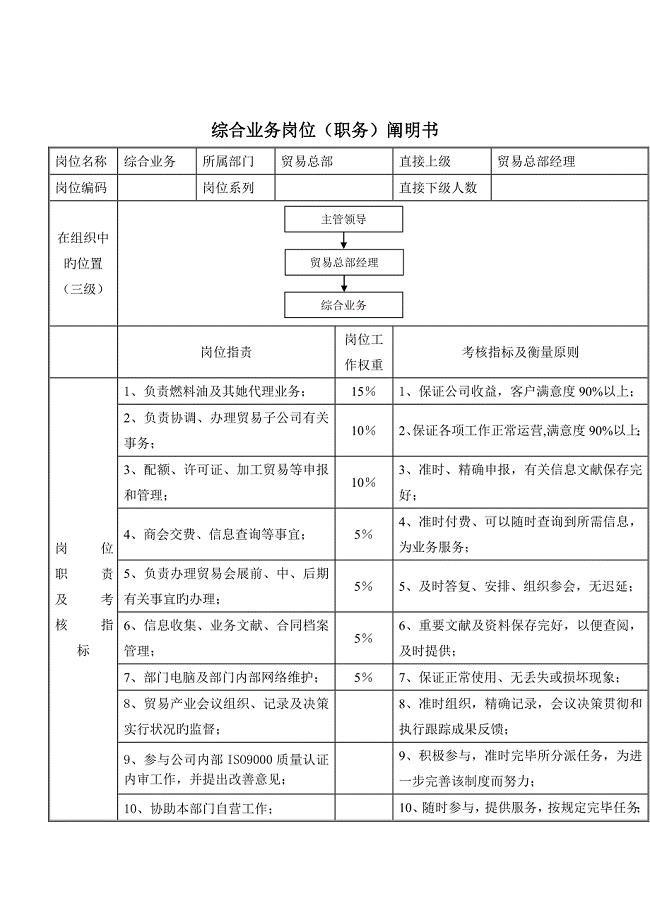
贸易总部综合业务岗位基本职责

浙江佳境玻璃科技有限公司建设项目阶段性竣工环境保护验收监测报告

二年级浙教版语文下学期选词填空摸底专项练习题

危险品道路运输“一车一品”材料汇总

中学教师学期末工作总结(3篇).doc

检察院实习报告3000

夫妻的离婚协议样本(2篇).doc

2022年高考理综选择题专项训练(6)

创卫档案资料整理

中学生感恩父母学生演讲稿范文汇编五篇
 实际问题与一元二次方程第二课时同步练习含答案
实际问题与一元二次方程第二课时同步练习含答案
2022-09-09 8页
 菜根谭读书笔记
菜根谭读书笔记
2022-07-24 37页
 启智阅读(1)
启智阅读(1)
2022-08-27 17页
 人教版语文六年级下册词语盘点和日积月累(田字格)
人教版语文六年级下册词语盘点和日积月累(田字格)
2023-06-27 9页
 北京市海淀区高三一模文综政治试题
北京市海淀区高三一模文综政治试题
2023-10-24 8页
 部分中外数学家及其伟大的贡献
部分中外数学家及其伟大的贡献
2022-07-20 14页
 模块2 实操题
模块2 实操题
2022-12-02 3页
 管理会计期末复习资料
管理会计期末复习资料
2024-02-04 103页
 车用柴油机废气再循环系统
车用柴油机废气再循环系统
2024-01-28 7页
 班级平安夜活动策划书.doc
班级平安夜活动策划书.doc
2022-09-04 6页

