
人用疫苗总论
9页1、人用疫苗总论1概述疫苗是以病原微生物或其组成成分、代谢产物为起始材料,采用生物技术制备而成,用 于预防、治疗人类相应疾病的生物制品.疫苗接种人体后町刺激免疫系统产生特异性体液免 疫和或细胞免疫应答,使人体获得对相应病原微生物的免疫力.本总论所述疫苗系指用 于传染病预防的人用疫苗,按其组成成分和生产工艺可分为以下类型.1.1灭活疫苗是指病原微生物经培养、增殖,用理化方法灭活后制成的疫苗,如百口咳疫苗、甲型肝 炎灭活疫苗等.1.2减毒活疫苗是指采用病原微生物的自然弱毒株或经培养传代等方法减毒处理后获得致病力减弱、免 疫原性良好的病原微生物减毒株制成的疫苗,如皮内注射用卡介苗、麻疹减毒活疫苗等.1.3亚单位疫苗是指病原微生物经培养后,提取、纯化其主要保护性抗原成分制成的疫苗,如A群脑 膜炎球菌多糖疫苗、流感亚单位疫苗等.1.4基因工程重组蛋白疫苗是指采用基因重组技术将编码病原微生物保护性抗原的基因重组到细菌如人肠杆菌、 酵母或细胞,经培养、增殖后,提取、纯化所表达的保护性抗原制成的疫苗,如重组乙型肝 炎疫苗等.1.5其他类疫苗由不同病原徼生物抗原混合制成的疫苗为联合疫苗,如吸附百白破联合疫苗
2、、麻嗯风联 合减毒活疫苗:由同种病原微生物不同血清型的抗原混合制成的疫苗为多价疫苗,如A群C 群脑膜炎球菌多糖疫苗、双价肾综合征出血热灭活疫苗:由病原微生物的保护性抗原组分与 蛋白质载体结合制成的疫苗为结合疫苗,如A群C群脑膜炎球菌多糖结合疫苗.本总论是对人用疫苗生产及质量限制的通用性要求,具体品种还应符合本版药典各论的 要求.2过程限制的根本要求2.1全过程质量限制疫苗是由具有免疫活性的成分组成,生产过程使用的各种材料来源及种类各异,生产工 艺复杂且易受多种因素影响,应对生产过程中的每一个工艺坏节以及使用的每一种材料进行 质量限制,并制定其可用于生产的质量限制标准;应制定工艺过程各中间产物可进人后续工 序加工处理的质量要求,应对生产过程制定偏差限制和处理程序.2.2批间一致性的限制应对关键工艺步骤的中间产物的关键参数进行测定,并制定可接受的批间一致性范围. 对半成品配制点的限制应选择与有效性相关的参数进行测定,半成品配制时应根据有效成分 测定方法的误差、不同操作者之间及同一操作者不同次操作之间的误差综合确定配制点.对 成品或疫苗原液,应选择多个关键指标进行批间一致性的限制.用于批间一
3、致性限制的测定方法应根据相关要求进行验证,使检测结果可准确有效地用 于批间一致性的评价.2.3目标成分及非目标成分的限制疫苗的目标成分系指疫苗有效成分.应根据至少能到达临床有效保护的最低含量或活性 确定疫苗中有效成分的含量及或活性;添加疫苗佐剂、类别及用量应经充分评估.疫苗的非目标成分包括工艺相关杂质和制品相关物质/杂质.工艺相关杂质包扌舌来源于 细胞基质、培养基成分以及灭活和提取、纯化工艺使用的生物、化学材料残留物等:制品相 关物质/杂质包括与生产用菌毒种相关的除疫苗有效抗原成分以外的其他成分以及抗原成分 的降解产物等.生产过程中应尽可能减少使用对人体有毒、有害的材料,必须使用时,应验征后续工艺 的去除效果.除非验证结果提示工艺相关杂质的残留屋远低于规定要求,且低于检测方法的 检测限,通常应在成品检定或适宜的中间产物限制阶段设定该残留物的检定项.应通过工艺研究确定纯化疫苗的制品相关物质/杂质,并采用适宜的分析方法予以鉴定. 应在成品检定或适宜的中间产物限制阶段进行制品相关物质/杂质的检测并设定可接受的限 度要求.3疫苗生产用种子批系统疫苗生产用种子批系统包扌舌生产用菌毒种及基因工程疫
4、苗生产用细胞株,应符合本版药 典的相关要求.种子批系统通常包括原始种子/细胞种子、主种子批/主细胞库和工作种子批/工作细胞 库,建立种子批系统的目的旨在保证疫苗生产的一致性和连续性.应建立主种子批/主细胞 库和工作种子批/工作细胞库并规定使用的限定代次.3.1三级种子系统原始种子/细胞种子是指经培养、传代及遗传稳定性等研究并经鉴定可用于疫苗生产的 菌毒种或者细胞株,可以是一个代次的,也可以是多代次菌毒种或者细胞株,是主种子批/ 主细胞库前各代次种子的总称;原始种子/细胞种子用于主种子批/主细胞库的制备.外购或 经技术转让获得的生产用种子,应按规定建立主种子批/主细胞库,主种子批/主细胞库前的 种子应根据原始种子/细胞种子治理.主种子批/主细胞库是指由原始种子/细胞种子经传代,并经同次操作制备获得的组成均 一的悬液.主种子批/主细胞库应为一个固定代次,用于工作种子批/工作细胞库的制备.工作种子批/工作细胞库是指由主种子批/主细胞库经传代,并经同次操作制备获得的组 成均一的悬液.工作种子批/工作细胞库应为一个固定代次,用于疫苗的生产.种子批系统各种子批/细胞库应在符合中国现行?药品生产质量
《人用疫苗总论》由会员汽***分享,可在线阅读,更多相关《人用疫苗总论》请在金锄头文库上搜索。

品质年终工作总结(2篇).doc

幼儿园学前班最新评语
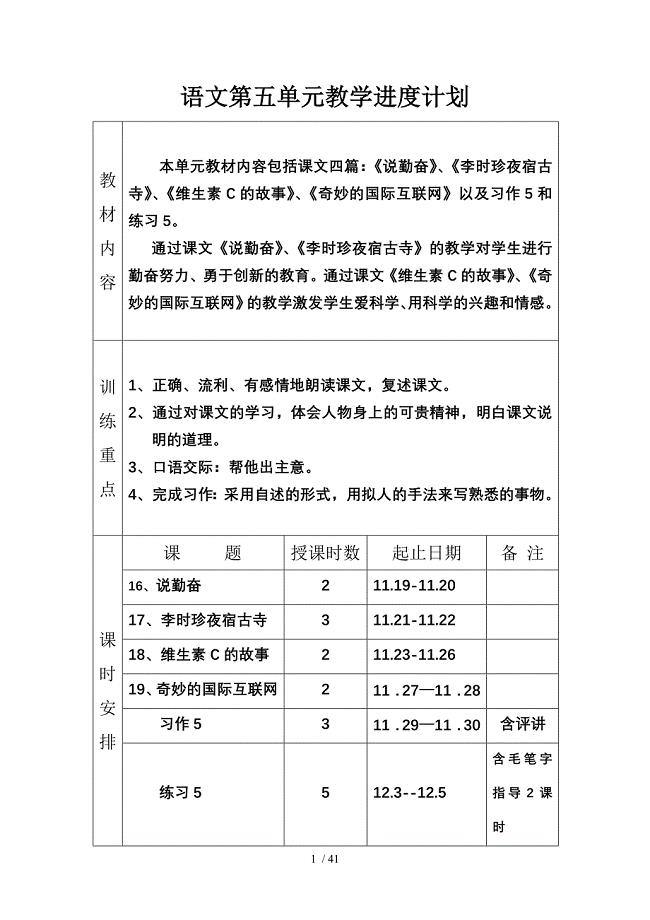
语文第五单元教学进度计划

大班美术教案《青花瓷盘》课程设计

新《施工组织设计》某某医院水电技术标8

第二审诉讼委托代理合同

再生资源回收利用建设项目商业计划书写作模板-招商融资代写

企业行政制度范本企业行政管理制度

五年级外研版英语下学期连词成句专项针对练习

2023年高三英语上教学总结(2篇)

安心账户(交易资金)托管协议(三方)

2022年广西省建筑施工企业三类人员安全生产知识ABC类【官方】考试题库33含答案

《认识时间》教学反思_3

山东省潍坊市2012届高三第二次模拟考试英语word版(潍坊二模)

工作方案四篇

2023年地产合同管理制度篇

电动工具电枢轴项目商业计划书写作模板-代写定制

2022年创新党组织全年工作总结

教导处工作计划2023年(四篇).doc

年家乡环境调查报告范文
 上课玩手机检讨书范例
上课玩手机检讨书范例
2023-04-23 12页
 写春节的作文400字七篇
写春节的作文400字七篇
2022-08-09 9页
 简短的幼儿园毕业感言
简短的幼儿园毕业感言
2023-08-12 7页
 交通基础设施建设战情况
交通基础设施建设战情况
2023-07-16 5页
 高中阶段的自我评价
高中阶段的自我评价
2023-02-12 4页
 房屋建筑混凝土主体结构工程实体现场检测方案
房屋建筑混凝土主体结构工程实体现场检测方案
2023-07-25 15页
 幼儿园的表扬信范文集锦5篇
幼儿园的表扬信范文集锦5篇
2023-02-17 7页
 护理实习生个人工作总结5篇
护理实习生个人工作总结5篇
2023-10-08 9页
 端午节珠宝促销活动方案范文
端午节珠宝促销活动方案范文
2024-01-28 4页
 幼儿园春季的园长工作计划
幼儿园春季的园长工作计划
2022-09-20 18页

