
(完整word版)与量有关的离子方程式总结,推荐文档
6页1、-# -反应物1反应物II滴加顺序Ca(OH) 2少量C02足量C02氨水少量S02足量S02AICI 3少量NaOHNaOH 滴入 AICI3足量NaOHAICI3滴入 NaOHNaAIO 2少量HCI盐酸滴入NaAI02足量HCINaAI02滴入盐酸FeBr 2少量CI2氯水滴入FeBr2足量CI2FeBr2滴入氯水Ca(OH) 2少量NaHC03NaHC03滴入石灰水足量NaHCO3石灰水滴入NaHC03Ca(HCO 3)2少量NaOHNaOH 滴入 Ca(HCO3)2足量NaOHCa(HCO3)2 滴入 NaOHAgNO 3少量NH3 H20NH3 H2O 滴入 AgN03足量NH3 H20AgN03 滴入 NH3 H2O与量有关的离子方程式的书写技巧:a.生成物与过量的反应物继续反应的情况:例:AICI3 与 NaOH (由少到多):Al3+ + 30H -宀 AI(OH) 3 J AI(OH) 3 + OH -宀 AQ2- + 2H 2。b.滴加顺序不同,离子反应不同:例:Na2CO3 中逐滴加入 HCI:CO32- + H + 宀 HCO3- HCO3- + H + 宀
2、H2O + CO 2 fNaOH 中逐滴加入 AICI3: AI3+ + 4OH -宀 AIO2- + 2H 2O 3AIO2- + AI 3+ + 6H 2O 宀 4AI(OH) 3 JC. 一种物质中有两种离子参加反应时,反应物用量不同,反应不同书写原则:不足量物质参加反应的离子按组成比参加反应,而过量物质则按需要确定其离子的物质的量。离子方程式Ca2+ + 2OH - +CO 2 CaCO3 J +H 20Ca2+ + 2OH - +2CO 2 Ca2+ +2HCO 3-2NH3 H2O +2SO 2 2NH4+ +SO 32- +H 20NH3 H2O +2SO2 2NH4+ +HSO 3-AI3+ + 3OH - AI(OH) 3 JAI3+ + 4OH - AIO2- + 2H 20H+ + AIO2- + H 2O AI(OH) 3 JAIO2-+ 4H + 2H2O + AI 3+2Fe2+ + CI2 2Fe3+ +2CI-2Fe2+ +4Br - +3CI 2 2Fe3+ + 2Br 2 +6CI-Ca2+ +OH - +HCO 3- CaC03 J +H 2OCa
3、2+2OH -+2HCO 3- CaCOs J +2H 2O+ CO 32-Ca2+ +OH - +HCO 3- CaCO3 J +H2OCa2+2OH +2HCO 3- Cag J +2H 2O+ CO 32-Ag+ +NH 3 H2O AgOH J + NH4+Ag+ +2NH 3 H2O Ag(NH 3)2+ + 2H 20、生成的产物可与过量的物质继续反应的离子反应1、向AICI3溶液中滴入NaOH溶液至过量,其离子反应分步写(1) Al3+ + 3OH - = AI(OH) 3 J(2) AI(OH) 3 + OH - = AIO 2- + 2H 2O2、若向NaOH溶液中滴入AICI3溶液至过量,其离子反应分步写(1) AI3+ + 4OH - = AIO 2- + 2H 20(2) 3AIO2- + AI 3+ + 6H 20 = 4AI(0H) 3 J3、 若向AICI3溶液中加入过量NaOH溶液,其离子反应一步完成A产 + 4OH - = AIO 2- + 2H 2。4、若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为A产 + 3OH - = A
4、I(OH) 3 J5、向NaAIO2溶液中滴入盐酸溶液至过量,其离子反应分步写(1) AIO2- + H + + H 2O = AI(OH) 3 J(2) AI(OH) 3 + 3H + = AI 3+ + 3H 206、若向盐酸溶液中滴入NaAIO 2溶液至过量,其离子反应分步写(1) AIO2- + 4H + = AI 3+ + 2H 2O(2) 3AIO2- + AI 3+ + 6H 2O = 4AI(OH) 3 J7、若向NaAIO 2溶液中加入过量盐酸溶液,其离子反应一步完成AIO2- + 4H + = AI 3+ + 2H 2O8、若向足量NaAIO 2溶液中加入少量的盐酸溶液,其离子方程式为AIO2- + H + + H 2O = AI(OH) 3 J9、向NaAIO 2溶液中通人CO2气体至过量,其离子反应分步写(1) 2AIO2- + CO 2 + 3H 2O = 2AI(OH) 3J + CO 32(2) CO32- + CO 2 + H 2O = 2HCO 3-10、若向NaAI0 2溶液中通人过量CO2气体,其离子反应一步完成AIO 2- + CO 2 + 2H
《(完整word版)与量有关的离子方程式总结,推荐文档》由会员壹****1分享,可在线阅读,更多相关《(完整word版)与量有关的离子方程式总结,推荐文档》请在金锄头文库上搜索。

爆炸、泄漏、中毒事故现场应急处置措施

感谢你陪伴作文初二作文600字

大学德育工作总结范文(二篇).doc

Oracle 10g数据库开发培训教程1

晋升与调岗管理规定(范本)

化学必修一总复习知识点整理2022

管沟施工方案设计

读书激发思想思想照亮生活-------学习魏书生教育思想心得体会 (2)

国际幼儿园项目商业计划书副本

2022年见证取样检验制度范本

xx关于成立社会扶残助残公司分析报告_模板
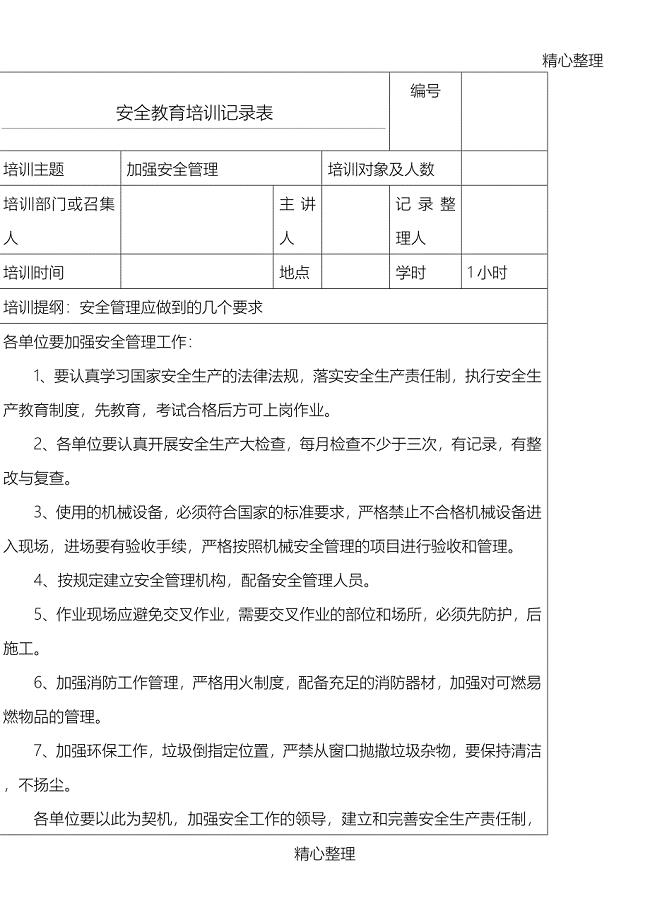
安全教育培训记录表

成都商报区域垄断优势推动业务逆势走强受互联网

人教版小学音乐三年级上册《动画城》教案

行政法与行政诉讼法期末复习资料

办公室工作职责例文

江苏省苏锡常镇四市高三5月教学情况调研(二)数学试题及答案

如何才能拍摄“成组”的镜头

责任的优秀作文800字高中责任作文五篇精选
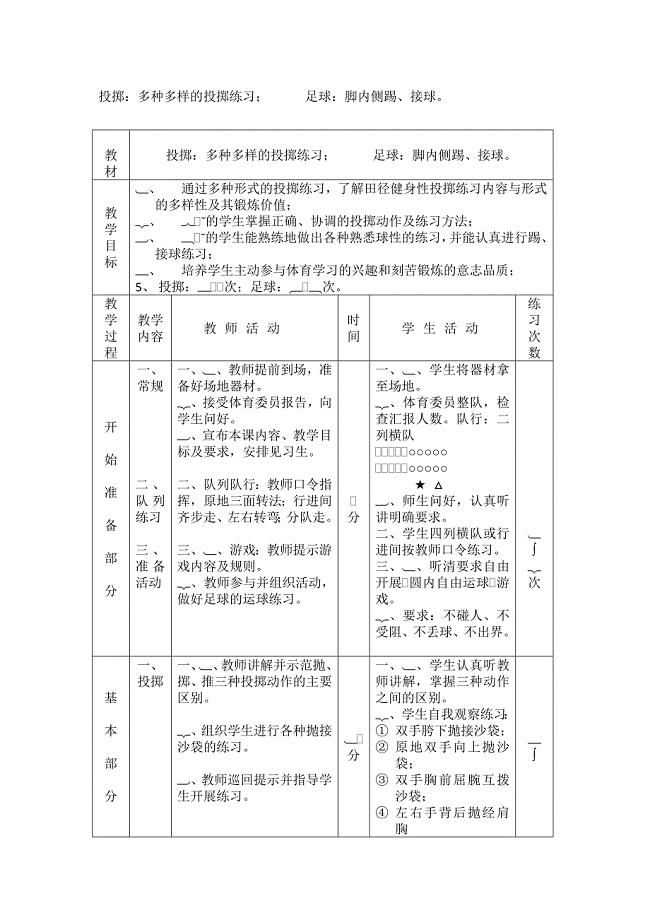
多种多样的投掷练习
 高中应用文作文一封来自天堂的信
高中应用文作文一封来自天堂的信
2023-07-07 1页
 七年级英语上第二单元测试2
七年级英语上第二单元测试2
2023-08-05 3页
 包芯线项目创业计划书写作模板
包芯线项目创业计划书写作模板
2023-05-04 40页
 稀土材料项目可行性研究报告写作范本
稀土材料项目可行性研究报告写作范本
2023-09-19 108页
 2019年全区节能知识竞赛试题及答案
2019年全区节能知识竞赛试题及答案
2023-04-07 15页
 2015年西北农林科技大学园艺学概论凯程学员回忆版_共1页
2015年西北农林科技大学园艺学概论凯程学员回忆版_共1页
2023-05-29 1页
 2、2不同等级城市的服务功能
2、2不同等级城市的服务功能
2022-08-30 11页
 城西小学班主任考核方案
城西小学班主任考核方案
2023-05-30 12页
 炼焦用洗精煤项目商业计划书写作模板-定制代写
炼焦用洗精煤项目商业计划书写作模板-定制代写
2022-11-19 41页
 广告画册项目创业计划书写作模板
广告画册项目创业计划书写作模板
2022-12-16 40页

