
2017届高三化学综合试卷循环测试二
7页1、12017 届高三化学综合试卷循环测试二届高三化学综合试卷循环测试二可能用到的相对原子质量:可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 Al-27 Cu- 63.5Fe -56 Co -59 Ba- 137选择题(共选择题(共 40 分)分)单项选择题:本题包括单项选择题:本题包括 10 小题,每小题小题,每小题 2 分,共计分,共计 20 分。分。 1化学在生产、生活中有着广泛的应用。下列做法正确的是( )A农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量B回收制革工厂的边角皮料生产食用明胶,加工成食品增稠剂 C将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水 D食品加工时,尽可能多的使用各种色素、香味剂等添加剂,改善食品的品质 2下列有关化学用语表示正确的是( )ANH4Cl 的电子式:B中子数为 7 的碳原子:13CNH H H H + ClCCl 的原子结构示意图:D次氯酸的结构式:HClO+172 8 83居室装修用石材的放射性常用作为标准,发现 Ra 元素的居里夫人(Marie Curie)曾a226 88R两度获得诺贝尔奖。下
2、列叙述中正确的是( )A原子核外有 88 个电子 BRa 元素位于元素周期表中第六周期A 族a226 88RCRaCl2的熔点比 CaCl2高 DRa(OH)2是一种两性氢氧化物4下列物质提纯的方法正确的是( )A除去混在 NO2中的 NO:将气体与足量 O2混合B除去混在 CO2中的 SO2:将气体依次通过足量酸性 KMnO4溶液和浓硫酸C除去 KCl 溶液中的 K2CO3:加入过量 BaCl2溶液后过滤D除去乙酸中混有的乙醇:加入金属钠后蒸馏5.下列物质转化在给定条件下能实现的是( )2A B C D6.下列表示对应化学反应的离子方程式正确的是:( ) A氯气溶于水:Cl2H2O=HClHClO B向稀HNO3中滴加Na2SO3溶液:SO32+2H+=SO2+H2O C酸性溶液中KIO3与KI反应生成I2:IO35I6H=3I23H2O D向Na2SiO3溶液中通入过量SO2:SiO32+ SO2+ H2O=H2SiO3+SO32 7已知 X、Y、Z、W 四种短周期主族元素在周期表中的相对位置如图所示,其中 X 原子最 外层电子数是其电子层数的 2 倍。下列说法正确的是( ) A四
3、种元素的原子半径大小 rYrWrXrZ B元素 X 的含氧酸只有一种,元素 Y 则有两种 C元素 Z 的气态氢化物的稳定性比元素 Y 的强 D元素 Y 和 W 的氧化物是导致酸雨的主要原因8关于下列各实验装置图的叙述中,正确的是( )A装置可用于分离苯和溴苯的混合物 B装置可用于吸收 HCl 或 NH3气体 C装置可用于分解 NH4Cl 制备 NH3D装置b 口进气可收集 CO2或 NO 气体9 NA为阿伏伽德罗常数的值。下列说法正确的是( )A1 molCu 和足量热浓硫酸反应可生成 NA个 SO3分子 B3mol 单质 Fe 完全转变为 Fe3O4,失去 8 NA个电子 C过氧化钠与水反应时,生成 0.1mol 氧气转移的电子数为 0.4NA D密闭容器中 2molNO 与 1molO2充分反应,产物的分子数为 2NA 10利用如图电解装置从海水中提取 CO2,可减少温室气体含量。下列错误的是( )A. a 室的电极接电源的负极 B. 该装置将电能转化为化学能 C. c 室排出的碱液中含 NaOH D. a 室的电极反应式为: 4OH4e=2H2OO2不定项选择题:本题包括不定项选
4、择题:本题包括 5 小题,每小题小题,每小题 4 分,共计分,共计 20 分。每小题只有一个或两个选项符分。每小题只有一个或两个选项符合题意。合题意。11下列有关说法正确的是( ) A马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀BCH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g) 能自发进行,则该反应的H03C合成氨生产中将 NH3液化分离,一定能加快正反应速率,提高 H2的转化率 DMnS 悬浊液中滴加少量 CuSO4溶液可生成 CuS 沉淀,则 Ksp(CuS) Ksp(MnS)12. 下列有关说法正确的是( ) A. 常温下,pH8 的碱性溶液中不可能存在 H2CO3分子 B. 常温下,pH 均为 5 的盐酸与氯化铵溶液中,水的电离程度相同 C.将 BaCl2溶液滴入含酚酞的 Na2CO3溶液,红色逐渐褪去,说明 BaCl2溶液显酸性D. 0.1 molL1 CH3COOH 溶液加水稀释,溶液的 pH 和 CH3COOH 的电离度均增大 13. 下列实验操作、现象和结论均正确的是选项实验操作现象结论A分别加热Na2CO3和NaHCO3固体试管内壁均有水珠两种物质均受热分
《2017届高三化学综合试卷循环测试二》由会员jiups****uk12分享,可在线阅读,更多相关《2017届高三化学综合试卷循环测试二》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
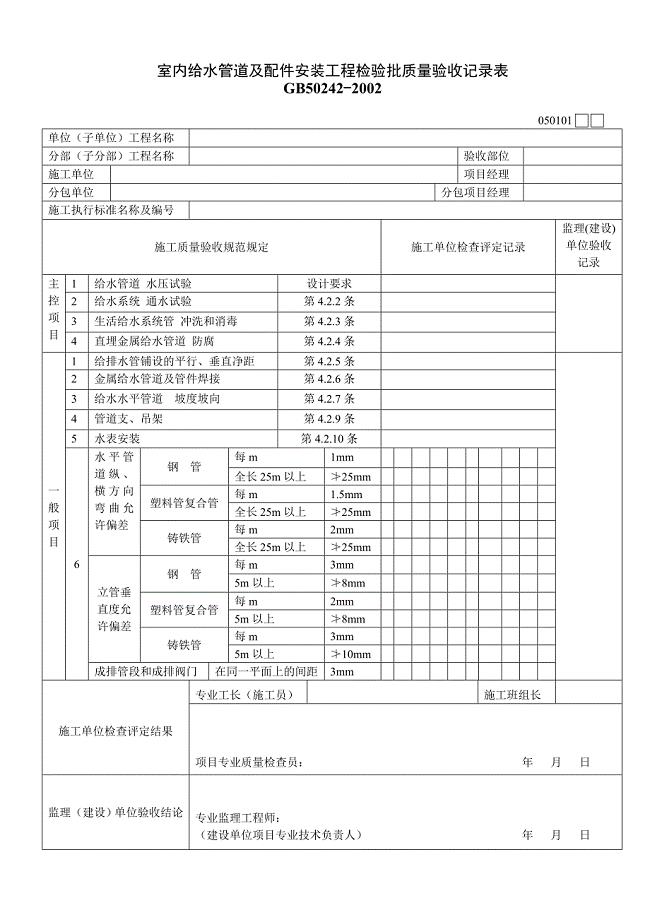
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 部品入厂检验标准(电子烟五金类)
部品入厂检验标准(电子烟五金类)
2024-04-24 8页
 部品入厂检验标准(烟油类)
部品入厂检验标准(烟油类)
2024-04-24 1页
 部品入厂检验标准(电芯类)
部品入厂检验标准(电芯类)
2024-04-24 1页
 部品入厂检验标准(电子烟硅、橡胶类)
部品入厂检验标准(电子烟硅、橡胶类)
2024-04-24 1页
 环境有害物质培训考核试题+答案
环境有害物质培训考核试题+答案
2024-04-24 3页
 电子烟塑胶件入厂检验品质标准
电子烟塑胶件入厂检验品质标准
2024-04-24 8页
 来料检验程序(电子烟)
来料检验程序(电子烟)
2024-04-24 5页
 怀化市怀铁二中中小学生防震减灾知识竞赛题库
怀化市怀铁二中中小学生防震减灾知识竞赛题库
2024-04-23 12页
 品烟师兼测试工程师岗位说明书
品烟师兼测试工程师岗位说明书
2024-04-23 5页
 IQC组长岗位说明书
IQC组长岗位说明书
2024-04-23 4页

