
【名校精品】高中化学鲁教版必修2学业分层测评:第1章 原子结构与元素周期律5 Word版含解析
7页1、名校精品资料-化学学业分层测评(五)(建议用时:45分钟)学业达标1(2016东营高一质检)下列氧化物对应的含氧酸酸性最强的是()ASiO2BN2O5CP2O5DCO2【解析】元素的非金属性越强,其最高价氧化物对应水化物的酸性就越强。显然其非金属性强弱的顺序为NPCSi。【答案】B2下列排列顺序正确的是()热稳定性:H2OHFH2S原子半径:NaMgO酸性:H3PO4H2SO4HClO得电子能力:CNOH2O;中Na和Mg电子层数相同,原子半径NaMg,而Mg比O多一个电子层,所以原子半径MgO;酸性H2SO4H3PO4。【答案】B3下列叙述中,通常不能作为判断两种元素得电子能力强弱依据的是()A其气态氢化物稳定性的强弱B单质氧化性的强弱C其最高价氧化物的水化物酸性强弱D单质熔点的高低【解析】单质熔点属于物理性质,与原子得电子能力无关。【答案】D4按C、N、O、F的排列顺序,下列递变规律错误的是()A原子半径逐渐减小B元素原子得电子能力逐渐增强C最高价氧化物对应水化物的酸性依次增强D气态氢化物稳定性逐渐增强【解析】C、N、O、F属同一周期的元素,且原子序数依次增大,原子半径逐渐减小,得
2、电子能力依次增强;气态氢化物稳定性依次增强;O、F无正价,也无最高价氧化物的水化物,故无法比较。【答案】C5对四种元素G、L、M、R的单质进行如下实验:GLMR和冷水反应无反应慢慢反应未试验未试验和2 molL1HCl反应溶解并放出气体溶解并放出气体无反应无反应和Rn的水溶液反应溶解并形成沉淀未试验溶解并形成沉淀未试验根据表中所给的实验结果,判断这四种元素金属活动性由强到弱的顺序正确的是()AL、G、R、M BG、L、M、RCL、G、M、R DL、R、G、M【解析】可从实验现象及结果推断。从与冷水反应情况可知L比G金属活动性强;从与2 molL1的盐酸反应可知G、L是较活泼的金属,M、R是不活泼金属,不与盐酸反应;M在Rn的溶液中溶解并形成沉淀,即M置换出R,M比R活泼,故选C。【答案】C6(2016青岛高一检测)下列能说明非金属性S强于P的是()AS的颜色比P4的颜色深BP4能在常温下自燃,而S不能C酸性:H2SH3PO4【解析】物理性质不能作为非金属性强弱的比较依据;P4的自燃是其着火点低的缘故,与非金属性无关;H2S不是S的最高价氧化物对应的水化物,也不能作为比较的依据。【答案】
3、D7下列有关说法正确的是()AH2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强BMg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼CH2S 300 时开始分解,H2O 1 000 时开始分解,说明O的非金属性比S强DNa和Mg与酸都能剧烈反应放出氢气,故无法比较它们的金属性强弱【解析】A项,比较非金属性强弱时,应比较最高价氧化物对应水化物的酸性;B项,Mg比Al活泼;D项,Na与水反应比Mg更剧烈,故金属性:NaMg。【答案】C 8同周期X、Y、Z三种元素的单质与等量H2化合时,释放出的能量大小关系为XYZ,下列判断不正确的是()A元素原子得电子能力:XYZB原子半径:XYYXD气态氢化物的稳定性按X、Y、Z的顺序逐渐增强【解析】元素的单质与H2化合时,其非金属性越强,化合时反应程度越剧烈,释放的能量越多,故非金属性:XYZ,气态氢化物的稳定性按X、Y、Z的顺序逐渐减弱。【答案】D9已知118号元素的离子aW3、bX、cY2、dZ都具有相同的电子层结构,下列关系正确的是()A质子数:cdB离子的还原性:Y2ZC氢化物的稳定性:H2YHZD原子半径:XX
《【名校精品】高中化学鲁教版必修2学业分层测评:第1章 原子结构与元素周期律5 Word版含解析》由会员pu****.1分享,可在线阅读,更多相关《【名校精品】高中化学鲁教版必修2学业分层测评:第1章 原子结构与元素周期律5 Word版含解析》请在金锄头文库上搜索。

公司加薪管理方案.doc

订单管理制度 (精选可编辑).DOCX

“一带一路”视阈下的对非职业教育援助的新探索科研论文报告.docx

综合练习课(第六课时)-教案优质公开课获奖教案教学设计(北师大版五年级上册).docx

现在完成时专项练习.doc

电气自动化设备管理办法范本.doc

二上数学第二单元练习题2

幼儿小班数学活动设计教案我给动物排排队

修2008年建筑工程计价试卷及答案.doc

一次函数复习课反思.doc

高定西服工艺设计

2019年劳动部工作计划书范文.doc

给食堂员工的表扬信模板

精品人教版九年级语文上册综合性学习练习题及答案
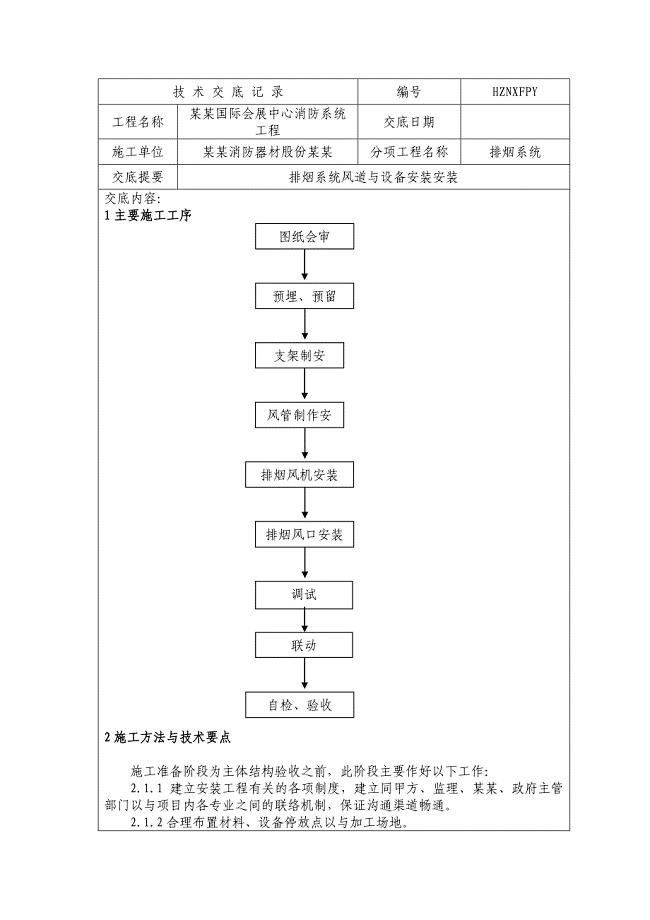
防排烟系统技术交底记录簿

025章.肌松药.doc

生产经理岗位职责.docx
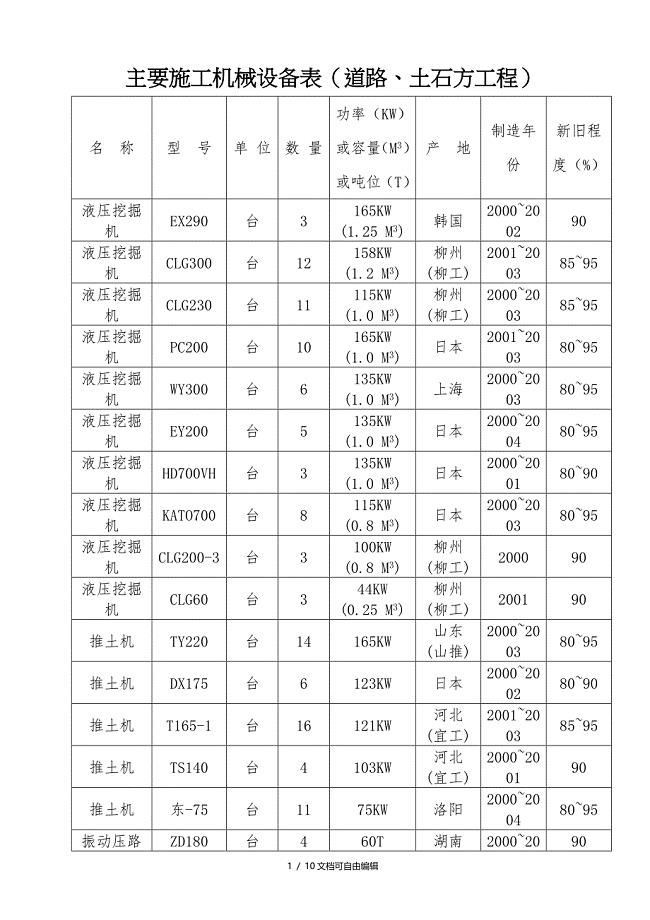
市政工程主要施工机械设备

关于疫情心得体会范文(3篇).doc

09年茶花品种.doc
 政务公开政务服务工作自查报告
政务公开政务服务工作自查报告
2022-09-19 7页
 辽宁省灯塔市九年级历史上册第八单元璀璨的近代文化练习无答案新人教版通用
辽宁省灯塔市九年级历史上册第八单元璀璨的近代文化练习无答案新人教版通用
2023-01-17 5页
 几种易误诊误治的耳鼻咽喉科疑难病症剖析.doc
几种易误诊误治的耳鼻咽喉科疑难病症剖析.doc
2023-05-17 10页
 江苏省常熟市七年级英语上学期期中质量监测卷
江苏省常熟市七年级英语上学期期中质量监测卷
2023-09-29 11页
 注册建筑师考试复习3287346443
注册建筑师考试复习3287346443
2022-09-13 17页
 小康社会统计监测指标体系及综合评价的方法
小康社会统计监测指标体系及综合评价的方法
2023-02-06 3页
 完形填空答案以及解析.docx
完形填空答案以及解析.docx
2023-06-09 12页
 图解内墙抹灰细部做法
图解内墙抹灰细部做法
2024-01-31 20页
 工作中怎样让迷惑的你认识真实的自己.docx
工作中怎样让迷惑的你认识真实的自己.docx
2022-11-23 4页
 代资真题(有答案).doc
代资真题(有答案).doc
2022-10-15 7页

