
第七章电极电势知识点
5页1、第七章 电极电势知识点一、解释并记忆1. 氧化数(又称氧化值) : 是某元素一个原子的荷电数,该荷电数(即原子所带的净电荷数)的确定是把成键电子指定给电负性较大的原子而求得。2. 氧化反应:失去电子使元素氧化数升高的过程叫氧化反应。3. 还原反应:得到电子使元素氧化数降低的过程叫还原反应。4. 氧化还原电对: 在氧化还原反应中,氧化剂与它的还原产物、还原剂与它的氧化产物组成的体系,称为氧化还原电对,简称电对。5. 氧化型物质: 在氧化还原电对中,氧化数较高的物质称为 氧化型物质。6. 还原型物质:7. 氧化还原半反应 :电对物质间的共轭关系式又称氧化还原半反应。9. 原电池:借助于氧化还原反应产生电流的装置称为原电池。10. 电动势(符号E):是指正、负极之间没有电流通过时的电极电势差。11. 电极的标准状态:通常将温度为298K,组成电极的各离子浓度为1mol/L ,各气体压力为100kPa时的状态,称为电极的标准状态(用上标“ 0 ”表示)二、简答题1. 简述确定氧化数的规则。答:确定氧化数的规则有: 1)单质中元素的氧化数为零。 2 )氢在化合物中的氧化数一般为 1 ;在二元金属
2、氢化物中氢的氧化数为 1。 3) 氧在化合物中的氧化数一般为 2; 在过氧化物中的氧化数为 1;在氟氧键中氧的氧化数为 2 ,如OF2 中。4 )简单离子的氧化数等于该离子的电荷数。5 )共价化合物中元素的氧化数等于原子在化合态时的“形式电荷”数。6 )在中性分子中,各元素氧化数的代数和为零;复杂离子(即多原子离子)所带的电荷数等于各元素氧化数的代数和。2. 简述氧化数法配平氧化还原反应方程式的原则。3. ( 1) 得失电子守恒, 即氧化剂中元素氧化数降低的总数等于还原剂中元素氧化数升高的总数。 ( 2) 质量守恒定律,即方程式两边各元素的原子或离子总数相等。4. 应用能斯特方程时需注意哪些事项?答:应注意: 1) 计算前,首先配平电极反应式。 2) 组成电极的物质中若有纯固体、纯液体( 包括水 ) 则不必代人方程中;若为气体则用分压表示( 气体分压代人公式时,应除以标准态压力 100kPa) 。 3) 电极反应中若有H+、OH等物质参加反应,H+或OH的浓度也应根据反应式写在能斯特方程中。5. 简述电极电势的应用答:1)比较氧化剂和还原剂的相对强弱电对的值越大,即电极电势越高,则该电
3、对中氧化型物质的氧化能力越强, 是强的氧化剂; 而其对应的共轭还原型物质的还原能力就越弱, 是弱的还原剂。 反之,巾9值越小,即电极电势越低,则电对中的还原型物质的还原能力越强,是强的还原剂;而其对应的氧化型物质的氧化能力越弱,是弱的氧化剂。2 ) 判断氧化还原反应进行的方向 氧化还原反应总是在得电子能力强的氧化剂与失电子能力强的还原剂之间发生。一般来说,当两个电对的 。0值相差较大时( ()0.2V0.4V),可直接由标准电极电势来 判断氧化还原反应的方向,一般浓度的变化不至于改变反应的方向,但若两个电对的()9值相差较小时,则必须根据Nernst 方程式计算出有关的电极电势或电池电动势,然后才能判断反应的方向。3)判断氧化还原反应进行的程度氧化还原反应属于可逆反应,在一定的条件下可达到平衡。反应进行的程度可以通过平衡常数 K 的大 小来衡量。当Ee 0.4V,则K106,可以认为反应已进行完全。三、选择题1. 氧化还原反应的实质是(D )A. 得氧和失氧B. 化合价的升降C. 有无新物质生成D. 电子的转移2. 氧化剂在反应中 (AD )A. 得电子B. 失电子C. 被氧化 D.
《第七章电极电势知识点》由会员工****分享,可在线阅读,更多相关《第七章电极电势知识点》请在金锄头文库上搜索。

公开课背后的故事.doc

服装销售安排模板九篇

农业银行创建省级文明单位工作汇报.doc

GMP2010版附录3生物制品.doc

部编人教版二年级数学上册全单元测试题及答案2.docx

三年级语文上《小摄影师》教学案例.doc
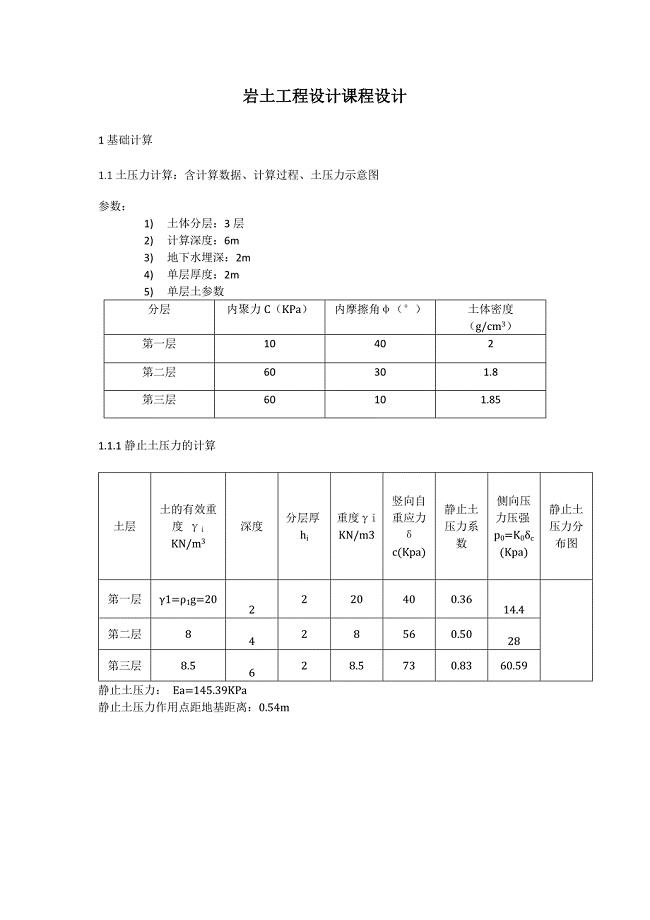
抗滑桩课程设计

传统文化月闭幕式主持人串词

重庆职称评定条件及要求.doc

下班遗忘打卡检讨书

《外商投资法》(双语对照版).docx

2022年MATLAB仿真瑞利衰落信道实验报告结果.doc

2023年学校办公室工作计划.docx

2021学年最新人教版九年级上册化学第三单元物质构成的奥秘巩固练习试卷【学生专用】.docx

出租车1安全目标

2022新部编人教版二年级上册《道德与法治》期中测试卷及答案【汇编】.doc

七年级下册语文教学设计:《口技》.docx

口吃自我矫正发音法疗法 (2).doc

技术创新与经济结构变迁综述
IATF16949风险控制程序-应急管理-风险评估-应急计划.doc
 提升人际交往能力的五把钥匙试题满分答案
提升人际交往能力的五把钥匙试题满分答案
2023-07-14 7页
 NYT 1717-2009 农业建设项目验收技术规程(标准分享网BZFXWCOM)
NYT 1717-2009 农业建设项目验收技术规程(标准分享网BZFXWCOM)
2022-07-29 93页
 鲁迅《好故事》教学教案
鲁迅《好故事》教学教案
2023-05-06 13页
 高考诗歌鉴赏常规问题设置以及11种答题模式
高考诗歌鉴赏常规问题设置以及11种答题模式
2023-12-08 10页
 成都市上期期末学业质量监测高一物理(含答案)
成都市上期期末学业质量监测高一物理(含答案)
2022-12-09 11页
 数学与应用数学专业本科人才培养方案(教师教育)
数学与应用数学专业本科人才培养方案(教师教育)
2023-02-11 6页
 金属基烧结摩擦片制造工艺的制作方法
金属基烧结摩擦片制造工艺的制作方法
2023-02-21 8页
 高级会计师工作业绩实例
高级会计师工作业绩实例
2023-04-01 2页
 工程签证与设计变更管理制度
工程签证与设计变更管理制度
2022-12-03 3页
 PDMS管道设计
PDMS管道设计
2023-11-13 27页

