
常见金属阳离子的检验方法
4页1、常见金属阳离子的检验方法 (1)+:焰色反应:火焰颜色呈黄色. (2)K+:焰色反应:火焰颜色呈紫色(透过蓝色钴玻璃)。 ()Ag+:加盐酸或可溶性的氯化物,生成不溶于强酸的白色沉淀。 (4)B+:加硫酸或可溶性的硫酸盐,生成不溶于强酸的白色沉淀。 (5)Ca+:加可溶性碳酸盐,生成白色沉淀;加强酸产生使澄清石灰水变浑浊的气体。 (6)Al+:加NaOH溶液,先出现白色胶状沉淀,后逐渐溶解。 (7)e2+:加NaOH溶液,产生白色胶状沉淀,迅速变成灰绿色,最后变成红褐色; 加KS溶液不变色,加氯水后溶液变红色。 (8)Fe3:加NaOH溶液,生成红褐色沉淀;加SCN溶液,溶液变血红色。1、SO42检验: 加稀盐酸,无变化 加入BaCl2溶液,有白色沉淀生成 B2 SO42 = aS2、CO32-检验:加入酸,生成无色无味气体 将气体通入澄清石灰水中,石灰水变浑浊。CO32-+ 2+=H2O + O C2+- CO2 = CCO3+ HO3、C-检验:加入AgNO3溶液,产生白色沉淀 加入稀硝酸,沉淀不溶解。Ag + Cl= C 4、NH4+检验 : 加入aOH溶液并加热,产生有刺激性气
2、味且能使湿润的红色石蕊试纸变蓝色的气体 NH4 OH =3 + H2、F3+ : 加入 KSCN溶液反应,溶液显血红色;6、Fe2+: 加入NaOH溶液,先产生白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀.e2+2OH=F(OH)2 (白色) 4e(O)2O2+2O=Fe()3(红褐色) 加入KCN溶液,不显红色,加入少量新制的氯水后,立即显红色.2Fe2+C2Fe3+Cl必修1化学方程式汇总一、钠及其重要化合物1、钠与非金属的反应4Na +O=N2O (白色) 2a + O Na2O2(淡黄色)2Na Cl2 点燃 NaCl、钠与水反应:2Na + 2HO = 2NaOH +2 (浮、熔、游、响、红)、 氧化钠 过氧化钠a2OH2=2NaOH 2NO2+2O=4NaO+O2 Na2O+CO2=Na2CO3 a2+2O22Na2CO+O N2O+2HCl2NCl+H2 2Na2O2+4Cl=NaCl+2H2OO26、N2CO3和NaHC3、与酸的反应N2CO3+2Hl2Nal+H2+CO2 NHCO3+H=Nal+H 2C2(反应速率更快)、与碱的反应Na2O3+C(H)2=CaCO+
3、2NH 2NaCO3+Ca(H)2CaCO3Na2CO+2HONaHCO3+NaO= Na2CO3+H2O、与盐的反应NaCO+Cal=2NaClCaCO3 N2CO3+BCl2=2NaC+BaO、相互转化2NaHCO3 Na2CO+H2O2 (加热分解)Na2CO+H2O+CO=2NaH (向a2O3溶液中通入足量的CO2)二、铝及其重要化合物 (结合A2O3和A(O)的两性进行记忆!)1、铝与非金属: Al + 3O= Al2O32、铝与弱氧化性酸:2Al + 6HC =ACl3 +3H2 Al6+ =l33H 铝与强氧化性酸:钝化(浓HSO4、浓HNO3)3、铝与碱:2Al+2NaOH +2H2O=2NaAlO2 +32; 2Al+H2O+2H=A2+3H2 、氧化铝与酸反应:2+ 6HCl = AlCl3 + 3H、氧化铝与碱反应:Al2O3 2NO = 2aAlO + 2H2O5、氢氧化铝制备:可溶性铝盐和N3H2AlC3+3NH3H2O=A(OH)33H4C l3+3NH3HO=A(OH)3+3N4、氢氧化铝的不稳定性: Al(H)3 A2O32O7、氢氧化铝与酸反应:Al
《常见金属阳离子的检验方法》由会员s9****2分享,可在线阅读,更多相关《常见金属阳离子的检验方法》请在金锄头文库上搜索。

加工型种薯购销合同

最新2022上半年银行从业资格考试公司信贷考试多选试题及解析(一)
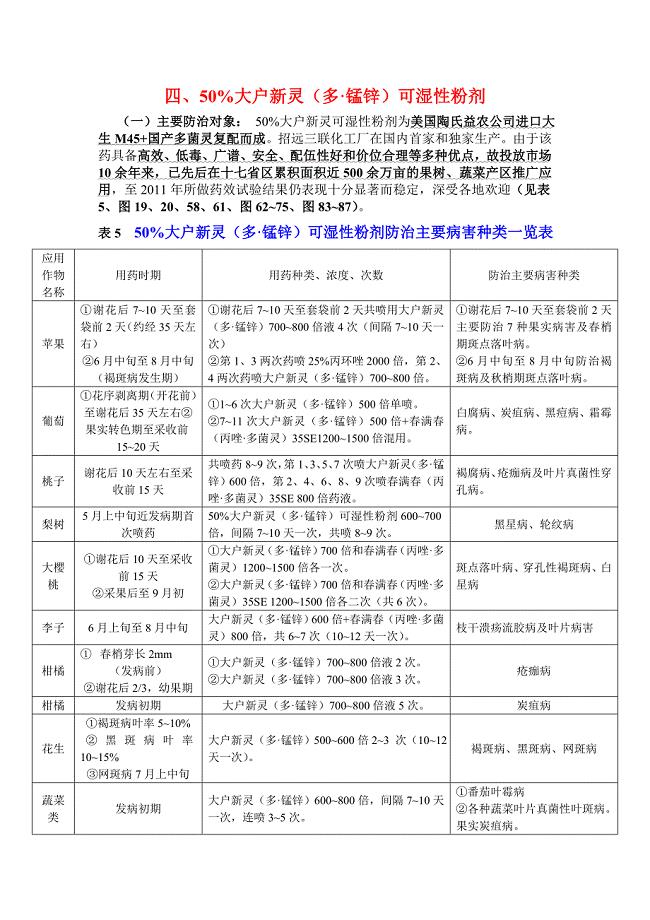
50%大户新灵可湿性粉剂防治主要病害苹果黑点红点轮纹病,果面光洁表光好.doc

2023年全国中考语文试题套汇编图表漫画.doc

2023年花炮产业合作调研报告 .doc

西师大二年级下册数学几何图形同步专项练习题

2011江苏物理高考试卷

初一英语书面表达训练尝试.doc

2023年优秀学生会部长推荐信.docx

最新九年级语文上学期同步单元双基双测期中考试B卷教师版 人教版

第16课 设置动画效果2.doc

13钓鱼的启示教案设计及教学反思 .doc

科技伦理与和谐社会的构建.doc

十佳少先队员演讲稿15篇.docx

2022年咨询工程师考试《组织与管理》模拟题(24).docx

201205销售管理本科-销售渠道管理-模拟试题.doc

第一单元图形的变换第一课时课题.doc

2023年未成年人社会主义核心价值观培育情况汇报.docx

工商管理本科标准外文翻译(有出处)大学论文

浅议国内商业银行运营管理的转型发展.doc
 2021年自动化仪表试题题库.doc
2021年自动化仪表试题题库.doc
2024-01-07 11页
 2021年河南省高中学生化学竞赛复赛.doc
2021年河南省高中学生化学竞赛复赛.doc
2023-01-09 3页
 志愿者组织简介
志愿者组织简介
2022-10-12 2页
 橡胶轴承压铸模具设计说明书样本.doc
橡胶轴承压铸模具设计说明书样本.doc
2023-03-10 81页
 ICU急救作业流程图.doc
ICU急救作业流程图.doc
2023-03-15 22页
 中医诊断学复习资料
中医诊断学复习资料
2023-08-05 19页
 修订院感制度样本.doc
修订院感制度样本.doc
2024-01-01 86页
 机械洛阳铲成孔人工清底钢筋混凝土灌注桩施工技术样本.doc
机械洛阳铲成孔人工清底钢筋混凝土灌注桩施工技术样本.doc
2023-10-30 22页
 黔东南州公共安全视频信息系统总体规划.doc
黔东南州公共安全视频信息系统总体规划.doc
2023-02-17 20页
 保安服务市场调研分析报告.docx
保安服务市场调研分析报告.docx
2023-04-24 10页

