
河北省邢台市高中化学第一章物质结构元素周期律第一节元素周期表(第2课时)导学案()新人教版必修2
18页1、河北省邢台市高中化学第一章物质结构元素周期律第一节元素周期表(第2课时)导学案(无答案)新人教版必修2第一章 第一节 元素周期表(第2课时)【学习目标】1.知道碱金属元素的原子结构及特点。 2. 能说出碱金属元素化学性质的相似性及递变性。 3.初步学会根据原子结构的特点,推测元素的化学性质。【重、难点】能说出碱金属元素化学性质的相似性及递变性。 【预 习 案】【导学流程】(一)基础过关1.参考元素周期表,完成下列表格元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数原子半径/nm碱金属元素锂0.152钠30.186钾0.227铷50.248铯60.265通过分析上表可知,碱金属元素原子的最外层上都有_个电子,很容易,因此碱金属元素的化合价都是_价。随着原子序数的增加,碱金属元素原子的电子层数_,原子半径逐渐_。碱金属元素原子结构的共同点是_,不同点是_,其变化规律是_。(二)预习检测1.下列关于碱金属元素的叙述中正确的是( )A.原子的最外层电子数都是1,次外层电子数都是8 B.单质的化学性质活泼,易失电子发生还原反应 C.除锂外均以化合态存在于自然界中D.化合物中碱金属元素的
2、化合价都为1价2.锂(Li)是世界上最轻的金属,它属于碱金属的一种,下列说法正确的是( )A.和Li同一主族的都是金属元素 B.Na比Li多一个电子层C.Li、Na、K的最外层都只有一个电子 D.Li是碱金属中原子半径最小的原子(三)我的疑问【探 究 案】一、碱金属元素的性质1.碱金属物理性质的变化规律物质名称颜色和状态密度/(gcm3)熔点/沸点/锂银白色,柔软0.534180.51 347钠银白色,柔软0.9797.81882.9钾银白色,柔软0.8663.65774铷银白色,柔软1.53238.89688铯略带金色光泽,柔软1.87928.40678.4碱金属单质具有_、密度_、熔点_、沸点_的特点。在碱金属内,随着元素原子核电荷数的增加,单质的熔点和沸点_。碱金属单质也有_,导_、导_性也很好,液态钠单质可用作核反应堆的传热介质。2. 碱金属化学性质(1)碱金属与O2反应已知1.4 g锂在空气中加热充分反应,可生成3.0 g氧化物,该反应的化学方程式是_。钠、钾与氧气的反应:将一小块Na和K分别投入热坩埚中,观察现象。(2)按下列实验操作完成实验,并填写下表碱金属钾钠实验操作实
3、验现象结论实验原理【归纳总结】1.碱金属的结构与化学性质的关系(1)相似性(R表示碱金属元素,不考虑放射性元素)原子都容易_最外层的一个电子,化学性质_,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R2H2O=2ROHH2。(2)递变性随着原子序数的递增,碱金属元素的原子失电子能力逐渐_,金属性逐渐_。它们和氧气的反应越来越容易,生成的氧化物越来越复杂;它们和水反应越来越_;碱金属都具有还原性,它们由弱到强的顺序是_。2.碱金属单质物理性质变化规律随着原子序数的递增,碱金属单质的密度逐渐_(钾反常),熔点、沸点逐渐_。3. 元素金属性强弱可以从单质与水(或酸)反应置换出氢的难易程度,或其最高价氧化物对应的水化物_的碱性强弱来判断。【课堂练习】1.下列关于碱金属的叙述中,不正确的是( ) A.随着原子序数的增加,元素的金属性逐渐增强 B.随着原子序数的减小,单质的还原性逐渐增强 C.熔点最高的也是相对原子质量最小的 D.密度最小的也是金属性最弱的2.下列各组比较不正确的是( ) A.锂与水反应不如钠与水反应剧烈 B.还原性:KNaLi,故K可以从NaCl溶液中置换出金属钠
《河北省邢台市高中化学第一章物质结构元素周期律第一节元素周期表(第2课时)导学案()新人教版必修2》由会员大米分享,可在线阅读,更多相关《河北省邢台市高中化学第一章物质结构元素周期律第一节元素周期表(第2课时)导学案()新人教版必修2》请在金锄头文库上搜索。

工业发展过程中的资源与环境问题探析.docx

泰勒科学管理理论在实际中的运用.doc

2013年4月证券预约式考试查询入口.doc

某公司财务分析报告

第四单元练习卷.docx

国际租赁协议.doc

第二批主题教育发言.docx

三基培训内容85727.doc

平面设计师模拟题
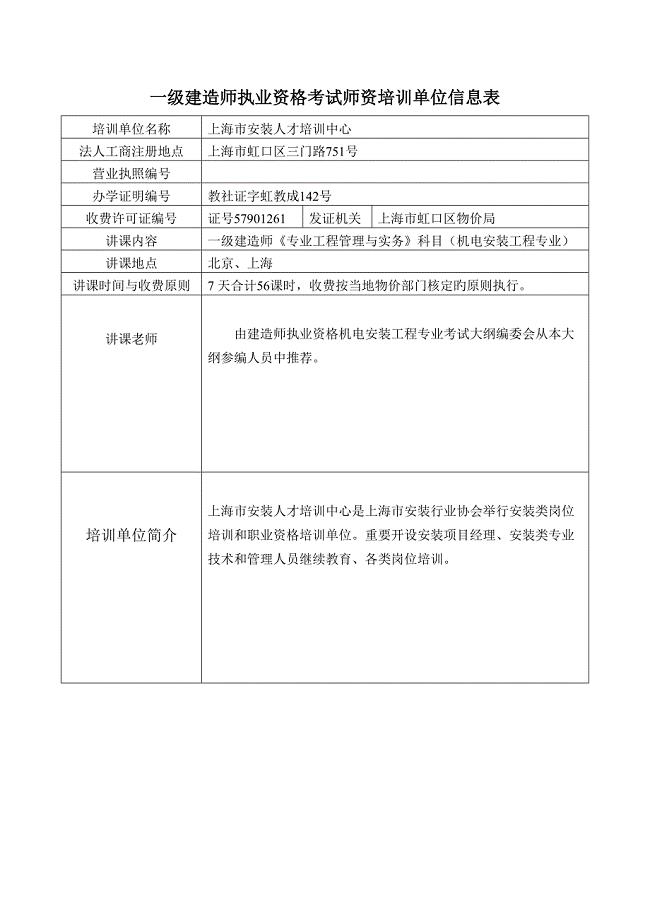
2023年继续教育培训单位.doc

南社站电网侧电化学储能工程总册.doc

指导青年老师工作计划参考范文(二篇).doc

生产部的安全管理职责.docx

建筑个人劳务合同.docx

脚手架施工组织设计

智能汽车零部件智造基地建设项目建议书写作模板

【良心出品】《岳阳楼记》教学设计.doc

2023年中级经济师工商管理精简排版直接打印版必看精华.doc

上海某别墅项目策划方案(doc 50页)

制药废水处理中试设计方案.doc
 BC300使用说明书
BC300使用说明书
2023-11-16 47页
![[信息技术2.0微能力]:小学六年级信息技术上(第二单元)--中小学作业设计大赛获奖优秀作品[模板]-《义务教育信息技术课程标准(2022年版)》](/Images/s.gif) [信息技术2.0微能力]:小学六年级信息技术上(第二单元)--中小学作业设计大赛获奖优秀作品[模板]-《义务教育信息技术课程标准(2022年版)》
[信息技术2.0微能力]:小学六年级信息技术上(第二单元)--中小学作业设计大赛获奖优秀作品[模板]-《义务教育信息技术课程标准(2022年版)》
2022-07-29 24页
 有关合作经营合同模板汇总六篇
有关合作经营合同模板汇总六篇
2022-11-24 45页
 模具零件加工工艺过程卡片
模具零件加工工艺过程卡片
2023-07-30 6页
 齐心合力-各显神通--彰显校园特色
齐心合力-各显神通--彰显校园特色
2023-10-02 4页
 期中考试后感想作文精选12篇
期中考试后感想作文精选12篇
2023-01-04 20页
 初二科学试卷附答案解析
初二科学试卷附答案解析
2023-06-27 15页
 DeDietrich客户投诉流程
DeDietrich客户投诉流程
2023-04-05 2页
 《特殊的葬礼》说课设计
《特殊的葬礼》说课设计
2024-01-07 5页
 人生格言警句78句
人生格言警句78句
2023-03-24 9页

