
初中酸碱盐反应规律小结
6页1、初中酸、碱、盐化学反规律小结(H) Cu Hg Ag一、用金属活动性顺序正确书写金属与酸、金属与盐的置换反应金属活动性顺序:KCaNaMgAlZnFeSnPbPtAu1 、金属与酸、金属与盐是否发生置换反应,既要根据金属活动性顺序加以判断,还要考虑酸和盐的特点。金属与酸反应:活泼金属+酸一-盐+氢气(H以前)(一般是稀HCl和稀H2SO)金属与盐反应:金属+盐新盐+新金属(反应必须在溶液中进行)(前置后)(可溶性盐)2 、金属与硝酸(浓、稀)和浓硫酸一般可以发生反应,但不属于置换反应,参加反应的金属也不受氢以后的限制。原因是这些酸有强氧化性,反应比较复杂,一般不生成氢气,而是生成水。故不能使用。如:(化学方程式初中不要求)4Zn+10HNO(稀)=4Zn(NO)2+NOT+5HOCu+2H2SO(浓)ACuSO+SOT+2H2O金属与浓盐酸可以发生置换反应产生氢气,但浓盐酸有挥发性,使产生的氢气混有氯化氢气体可以用碱溶液(如NaOHKOH液)吸收而除去,故不宜选择使用。碳酸(HCO)的酸性较弱(是弱酸),一般不选择。3 、金属与盐溶液反应时,参加反应的金属在金属活动性顺序中的位置比盐中
2、所含金属元素的位置要靠前;参加反应的盐必须是可溶性盐。两个条件同时具备置换反应才能进行。特别注意:对于“钾、钙、钠”等化学性质极为活泼的金属,跟盐溶液反应是时情况比较复杂,一般不属于置换反应,一般也不能把排在后面的金属从它们的盐溶液中置换出来。如:金属钠和硫酸铜溶液的反应,就不能把铜从它的盐溶液中置换出来。2Na+2H2O=2NaOH+Hd2NaOH+CuSO4=Cu(OH2;+NazSO总反应:2Na+CuSO+2H2O=Cu(OH2;+Na2SO+H2T4、特别注意:活泼金属“钾、钙、钠”与酸反应时,仍然是与酸直接反应。请不要和第3点的特别注意相互混淆。如:2Na+H2SO=NazS。+H2TK+HCl=KCl+H2T(不要认为先和水反应,再和酸反应)5、特别强调:单质铁与酸、与盐发生置换反应时,一般生成亚铁盐(其中Fe的化合价为+2价)。如:Fe+2HCl=FeCl2+H2TCuSO4+Fe=FeSO4+Cu二、根据复分解反应发生的条件和运用酸、碱、盐的溶解性表正确书写酸和碱、酸和盐、碱和盐、盐和盐的复分解反应。1 、复分解反应能否发生首先要考虑反应物的溶解性“这是前提条件.。当
3、反应物条件符合以卮,才能考虑一生成物是否符合复分解反应发生的条件,即生成物是否有沉淀或气体或水产生,如果有则复分解反应能进行,反之则不能进行。2 、酸的溶解性规律:初中接触的酸一般都可溶,其中H2SO、HPO是不挥发性酸。HCl、HNOH2CO有挥发性,是挥发性酸。但要注意HCO的挥发性表现为不稳定性(是化学性质):H2co=H2O+CO2T。碱的溶解性规律:钾、钠、佻俊KOHNaOHBa(OH2、NHHO的碱可溶,Ca(OH2微溶,其余的碱不溶。注意:氨水有挥发性,和H2CO一样,也表现为不稳定性(是化学性质):NH-HO=NH4+H2OAgOHfe白色沉淀,但非常不稳定,在溶液中生成的同时马上分解产生褐色的氧化银沉淀:2AgOH=AgOj+H2O盐的溶解性规律:钾、钠、俊盐、硝酸盐溶得快;盐酸盐(氯化物)不溶氯化银;硫酸盐不溶钢、银、钙(银、钙微溶);碳酸盐溶解钾、钠、俊(的碳酸盐),微溶碳酸镁,其它一般往下沉。注意:Fe2(CQ)3、Al2(CO3)3遇水分解。如:Fe(CQ)3+3H2O=2Fe(OH3,+3CQT3、酸和碱的反应:酸+碱盐+水(中和反应,属于复分解反应)(1)
4、、酸溶液与碱溶液的反应:一般都能发生反应,即酸碱不受限制。这种类型一般要求判断该化学反应是否发生和是否反应完全。A、如果反应没有明显现象,可以通过酸碱指示剂颜色的突然变化该化学反应是否发生和是否反应完全。如:NaOH+HCl=NaCl+H2O(见课本P实验)B、如果反应有沉淀产生,可以通过观察沉淀刚好不再产生(或不再增加)的现象判断该反应是否完全进行。如:Ba(OH2+H2SO=BaSO;+2H2O(2)、酸溶液与难溶性碱的反应:参加反应的酸一般是强酸,如HCl、H2SO、HNQ而碳酸(HCO)是弱酸,一般是不能与难溶性碱反应。此类型的反应主要现象是“难溶性碱(即固体反应物)逐渐减少(溶解)甚至消失。”当固体反应物刚好消失时,反应完全。如:Mg(OH2+H2SO=MgSO+2H2OCu(OH2+2HCl=CuCl2+2H2OCa(OH2(固体)+2HNO=Ca(NO)2+2H2O4、酸和盐的反应:酸+盐=新盐+新酸反应条件:参加反应的酸必须可溶于水。参加反应的盐一般也要溶于水,如果不溶于水,必须溶于酸。当反应物条件符合以后,再考虑生成物是否符合复分解反应发生的条件。具体反应条件说明如下
《初中酸碱盐反应规律小结》由会员m****分享,可在线阅读,更多相关《初中酸碱盐反应规律小结》请在金锄头文库上搜索。

公司行政管理制度(带封皮).docx

学生代表班级发言稿.docx

2023活动策划388范文.docx

《人力资源管理》.doc

2023年主题活动策划70.docx

江苏省高邮市近年-近年学年高一物理下学期期中试题(含解析)(最新整理).docx

防止高处坠落、物体打击的十项基本安全要求

丝瓜庄园一套.doc

学校安全制度汇编.doc

2023海的女儿教案2范文.docx

【教育资料】小学一年级语文《松鼠的尾巴》教案(1).doc

2022年12月英语四级阅读模拟题-爱美没商量.docx

大班语言活动健康生长教案反思.docx

集装箱海铁联运港口作业模式比较研究--毕业论文.docx
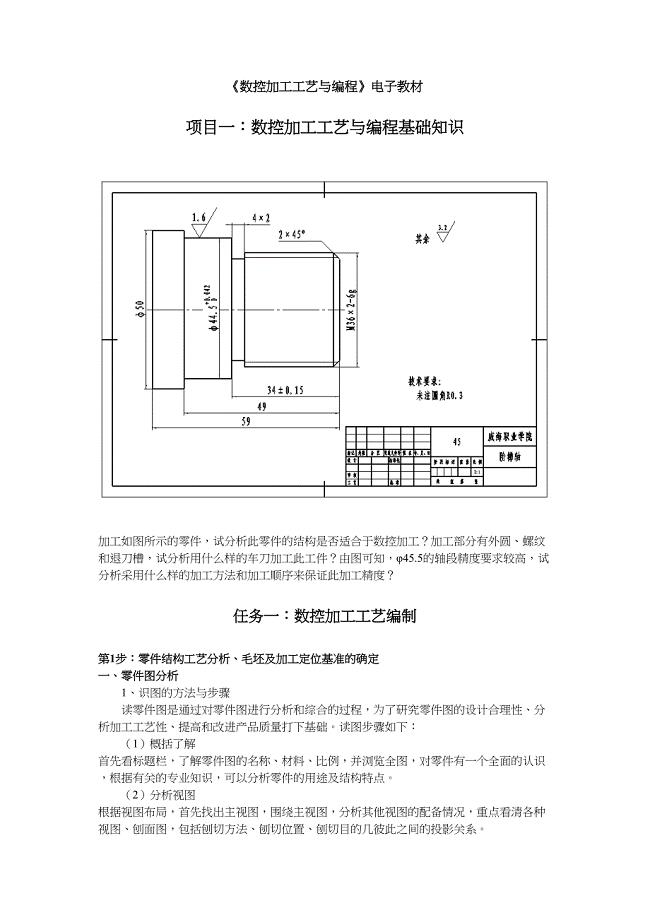
1.《数控加工工艺与编程》(天选打工人).docx

2012高考英语必背单词.doc

独山县肉牛养殖基地建设项目可行性研究报告.doc

2-09六年级词、句、语音、语法重点.doc

11.我是校园小主人12.docx

调音台的功能和使用.doc
 安全生产事故案例分析作业
安全生产事故案例分析作业
2023-12-21 14页
 硫回收12台非标设备技术协议080910(字)
硫回收12台非标设备技术协议080910(字)
2023-01-23 9页
 生鲜自营系统解决方案
生鲜自营系统解决方案
2023-02-09 29页
 上市公司配股行为的研究doc11
上市公司配股行为的研究doc11
2022-11-13 11页
 安全设施设计
安全设施设计
2023-12-22 284页
 承压类特种设备检验项目分类表
承压类特种设备检验项目分类表
2023-04-28 8页
 某公司施工组织设计课程
某公司施工组织设计课程
2023-05-29 78页
 剪力墙结构施工组织设计(DOC67)
剪力墙结构施工组织设计(DOC67)
2022-09-20 94页
 室内大班游戏
室内大班游戏
2022-12-18 4页
 企业处工作职责
企业处工作职责
2022-07-24 3页

