
新课标广西2019高考化学二轮复习题型六化学反应速率与化学平衡专项练
7页1、题型六化学反应速率与化学平衡1.80 时,在2 L密闭容器中充入0.40 mol N2O4,发生反应N2O4(g)2NO2(g)H=+Q kJmol-1(Q0),获得如下数据:时间/s0204060801000.000.120.200.260.300.30下列判断正确的是()A.升高温度该反应的平衡常数K减小B.2040 s内,v(N2O4)=0.004 molL-1s-1C.反应达平衡时,吸收的热量为0.30Q kJD.100 s时再通入0.40 mol N2O4,达到新平衡时N2O4的转化率增大答案C解析该反应为吸热反应,升高温度,平衡向正反应方向移动,平衡常数K增大,A错误。2040 s内,v(NO2)=0.004 molL-1s-1,v(N2O4)=v(NO2)=0.002 molL-1s-1,B错误。浓度不变时,说明反应已达平衡,此时,生成NO2 0.30 molL-12 L=0.60 mol,由热化学方程式可知,生成0.6 mol NO2吸收热量0.3Q kJ,C正确。100 s时再通入0.40 mol N2O4,相当于增大压强,平衡逆向移动,N2O4的转化率减小,D错误。
2、2.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:图1图2下列说法中正确的是()A.3040 min内该反应使用了催化剂B.化学方程式中的x=1,正反应为吸热反应C.30 min时降低温度,40 min时升高温度D.8 min前A的平均反应速率为0.08 molL-1min-1答案D解析由图1知,A、B的浓度变化相同,故A、B的化学计量数相同,都为1;由图2知,30 min时改变的条件为减小压强,40 min时改变的条件为升高温度,且升高温度平衡向逆反应方向移动,则正反应为放热反应,A、B、C错误。8 min前A的平均反应速率为v(A)=0.08 molL-1min-1,D正确。3.(2018四川绵阳模拟)在一定温度下,将等量的气体Z分别通入起始容积相同的密闭容器和中,使其发生反应,t0时容器中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是()A.该反应的化学方程式为3X+2Y2ZB.若两容器中均达到平
3、衡时,两容器的体积V()V(),则容器达到平衡所需时间小于t0C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体D.若达平衡后,对容器升高温度时,其体积增大,说明Z发生的反应为吸热反应答案C解析根据图像可知,Z是反应物,X、Y是生成物,达到平衡后,生成1.8 mol X和1.2 mol Y,消耗1.8 mol Z,则化学方程式为3Z3X+2Y,A错误;反应的化学方程式为3Z3X+2Y,若两容器中均达到平衡时,两容器的体积V()V(),则容器达到平衡时体积增大,压强比中小,达到平衡所需时间大于t0,B错误;若两容器中均达到平衡时,两容器中Z的物质的量分数相同,说明达到相同的平衡,即平衡不受压强变化的影响,即反应前后气体体积不变,所以Y为固体或液体,C正确;容器是恒压容器,若达平衡后,升高温度其体积增大,由于气体热胀冷缩,故不能说明平衡正向移动,Z发生的反应不一定为吸热反应,D错误。4.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+O2(g)SO3(g)H=-99 kJmol-1。某温度下该反应的平衡常数K=3.33。反应过程的
《新课标广西2019高考化学二轮复习题型六化学反应速率与化学平衡专项练》由会员pu****.1分享,可在线阅读,更多相关《新课标广西2019高考化学二轮复习题型六化学反应速率与化学平衡专项练》请在金锄头文库上搜索。
![生物进化的原因[1].docx](https://union.152files.goldhoe.com/2023-5/28/384525ea-b91f-4fed-b05d-17c6db22434f/pic1.jpg)
生物进化的原因[1].docx

气不足则胖血不足则瘦.doc

2023年江苏省苏州市太仓市沙溪镇项桥村社区工作人员考试模拟试题及答案

小学教师2022年年度考核工作总结

四川省2016年上半年造价工程师考试安装计量:常用涂料涂覆方法模拟试题

合并会计报表实务精要.doc

【教育资料】浙教义务版四年级语文上册教案-大自然的语言.doc

房地产公司财务部工作总结.doc

食品公司业务员工作计划范文(2篇).doc

厂房租赁合同解除协议

保密与竞业限制协议 (2)(天选打工人).docx

软件概要设计说明书(案例).doc

临汾麒麟电池研发项目商业计划书【模板范本】

最全的房地产开发公司管理制度员工手册.doc

2023万能实习生工作总结(3篇).doc
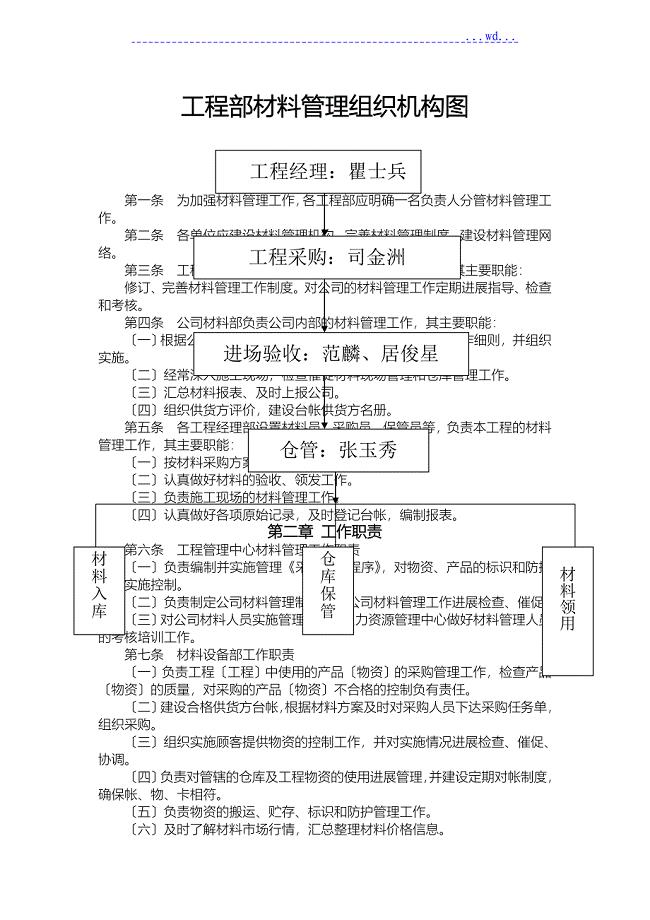
建筑施工材料管理规定

土地整理项目的实施方案

翼卡通产品介绍.doc

建筑公司劳务合同(汇编5篇).docx

外貌描写和肖像描写的区别.doc
 2022年高中英语 Unit 3《Life in the Future》教案(4) 新人教版必修5
2022年高中英语 Unit 3《Life in the Future》教案(4) 新人教版必修5
2023-01-25 2页
 2022年高三数学第四次数学理科模拟考试题及答案
2022年高三数学第四次数学理科模拟考试题及答案
2023-09-10 7页
 七年级语文上册 第一单元 1 春课后习题 新人教版
七年级语文上册 第一单元 1 春课后习题 新人教版
2023-03-21 2页
 高中英语校园园地英语论文语域知识在高中英语写作中的应用研究
高中英语校园园地英语论文语域知识在高中英语写作中的应用研究
2023-10-08 3页
 浙江省杭二中2022-2023学年高一物理第一学期期末达标检测模拟试题含解析
浙江省杭二中2022-2023学年高一物理第一学期期末达标检测模拟试题含解析
2022-09-30 14页
 开荒保洁承包合同
开荒保洁承包合同
2023-02-22 6页
 高考语文答题经常出现的25个问题
高考语文答题经常出现的25个问题
2023-06-02 7页
 2022年高中化学《有机物的组成、结构、分类和命名》全册复习导学案
2022年高中化学《有机物的组成、结构、分类和命名》全册复习导学案
2023-07-14 17页
 浙江省桐乡市实验中学片区2017届九年级上学期期中联考科学试卷(含答案解析).doc
浙江省桐乡市实验中学片区2017届九年级上学期期中联考科学试卷(含答案解析).doc
2022-09-12 10页
 云南省高中物理 5.5圆周运动学案 新人教版必修2
云南省高中物理 5.5圆周运动学案 新人教版必修2
2023-06-27 3页

