
非金属与化合物知识点总结
23页1、 .wd.非金属及其化合物知识点总结一、 碳族元素及无机非金属材料一、高考说明:1了解碳元素的单质及某些氧化物、氢化物、碳酸盐的性质。2了解碳的氧化物对大气的污染及其防治;初步了解粉尘对环境及人类安康的影响。3掌握碳族元素在周期表中的位置及与其性质的关系。4了解硅酸盐工业及新型无机非金属材料的性质与应用。二、命题趋势本专题知识涉及面广,实际应用性强,命题方向比较灵活,今后高考命题的方向是:与 基本理论、其他元素化合物知识糅合在一起,进展学科知识的综合考察。碳单质及其化合物在生活及高科技的开展中起着重要作用,其应用点较多,在以后的高考中将会有所表达。当今人们对材料技术的关注,超过了以往任何一个时期、反映新材料、新技术的知识将被移植到命题范围内,考察学生承受新信息的能力,这将是命题的趋势。三、知识网络1.碳及其化合物的知识网络CCO2 CaCO3 CaC2C2H2 CO有机物NH4HCO3 CH4 H2CO3 Na2CO3 NaHCO3 O2 SiC 、CCl4不完全燃烧O2(缺乏)O2 (缺乏)O2 CuO 炽热的碳NH3H2O O2 (点燃)H2O CaO Si、Cl2 ()Mg (点
2、燃)O2 (点)CuO ()C、CO Na2O2NaOH H2O NaOH H Ca(OH)2 高温H+ Ca2 CO2 、H2O Ca(OH)2 CO2 (水)OH 加热 Ca(HCO3)2 2.硅及其化合物的知识网络Na2SiO3 CO2,H2O NaOH H2SiO3 SiH4Si SiO2 CaSiO3 SiF4 H4SiO4 SiC SiCl4O2 (自燃)H2 O2()FeO (高温)F2 HF Cl2 (高温)H2(高温)C(高温)C(高温)足量Na2CO3 (高温)NaOH(溶液) CaO()CaCO3 ()Ca2 -H2O C(适量)(四)、根基知识1.碳族元素碳族元素的特征:碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。碳族元素的化合价:碳族元素的主要化合价有+2,+4,其中铅+2价稳定,其余元素+4价稳定。碳族元素的递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常
3、典型。其中碳是非金属,锡、铅是金属,硅、锗是半导体材料。碳族元素在自然界里的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在几种同素异形体:碳:金刚石、石墨、C60、C70等;硅:晶体硅,无定形硅2.碳在常温下碳很稳定,只在高温下能发生反响,通常表现为复原性。燃烧反响与某些氧化物的反响:CCO22CO;C2CuOCO22Cu;CH2OCOH2OCO、H2的混合气体叫水煤气;2C+SiO2Si+2CO与氧化性酸反响:C2H2SO4浓CO22SO22H2O;C4HNO3浓CO24NO22H2O3.CO不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的不安全性。可燃性复原性:CO+CuOCO2Cu,CO+H2O(g)CO2+H2O4.CO2直线型OCO非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。固态CO2俗称干冰,能升华,常用于人工降雨。实验室制法:CaCO32HClCaCl2CO2H2O。酸性氧化物一酸酐Ca(OH)2CO2CaCO3H2O(用于检验CO2)氧化性:CO2C2
4、CO;2MgCO22MgOC5.碳酸盐溶解性:Ca(HCO3)2CaCO3;Na2CO3NaHCO3。热稳定性:Na2CO3CaCO3;碱金属正盐碱金属酸式盐: Na2CO3NaHCO3。相互转化:碳酸正盐碳酸酸式盐(除杂用) 6.硅硅在地壳中只有化合态,没有游离态。其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反响:Si+2F2SiF4、Si+4HFSiF4+2H2、Si+2NaOH+H2ONa2SiO3+2H2;在加热条件下,能与氧气、氯气等少数非金属单质化合:SiO2SiO2。制备:在电炉里用碳复原二氧化硅先制得粗硅:SiO22CSi2CO,将制得的粗硅,再与C12反响后,蒸馏出SiCl4,然后用H2复原SiCl4可得到纯硅。有关的反响为:Si十2C12SiCl4、SiCl4+2H2Si+4HCl。硅在高新技术中的应用:高纯硅可作半导体材料 7.SiO2SiO2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。而CO2通常状况下是气体,
《非金属与化合物知识点总结》由会员夏**分享,可在线阅读,更多相关《非金属与化合物知识点总结》请在金锄头文库上搜索。

2014年人教版新目标英语八年级下册教学计划.doc

传统针灸之精髓.doc

2023年最新实习生工作计划(完整)

《小池》2 (2).docx

市司法局关于开展行风评议工作的情况汇报.docx
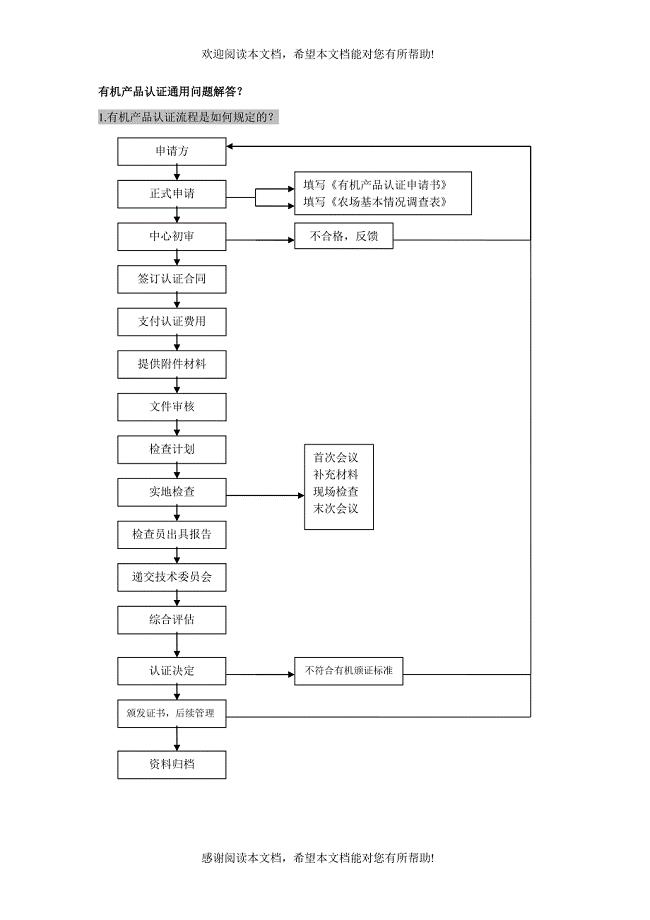
有机产品认证通用问题解答?

超市采购部个人工作总结2023年范本(二篇).doc

2023届广东省广州市天河中学物理高二下期末达标测试试题(含解析).doc

七年级历史知识点归纳.doc

直线与圆锥曲线的位置关系习题.doc

讲好森林故事守护绿水青山优秀作文.docx

高考语文备考-作文抢分攻略.doc
(AI)3D功能绘精致立体骰子.doc

糖尿病足溃疡和糖尿病足发病介绍.doc

册亨桔梗加工建设可行性论证报告.doc

简单房屋租赁合同格式范本(六篇)

2023年庆祝香港回归25周年征文10篇

学习雷锋钉子精神心得(三).doc

五种营销策略服务好存量客户.doc

药品批发100问
 消毒供应中心管理制度汇编
消毒供应中心管理制度汇编
2023-06-13 76页
 CUDA3.0编程模型
CUDA3.0编程模型
2023-03-14 5页
 VB基础教程第一章第一节共1节
VB基础教程第一章第一节共1节
2023-11-25 10页
 体育组集体备课记录
体育组集体备课记录
2023-10-11 5页
 组合体的形体分析_教学设计
组合体的形体分析_教学设计
2022-11-26 8页
 文书档案管理复习题整理高纲.doc
文书档案管理复习题整理高纲.doc
2022-09-08 12页
 ASP数据库操作大全
ASP数据库操作大全
2023-03-09 19页
 顶尖数控雕刻机使用说明书
顶尖数控雕刻机使用说明书
2024-02-09 9页
 物业公司保安部常用表格
物业公司保安部常用表格
2023-03-31 22页
 大学体育垒球课学习心得
大学体育垒球课学习心得
2023-08-21 1页

