
电化学基础专题复习打印稿教师MicrosoftW
13页1、电化学基础专题复习【课标考纲要求】(1)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。(2)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。一、原电池【实验】把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯里,可以看到锌片上有气泡产生,铜片上没有气泡产生。再用导线把锌片和铜片连接起来,观察铜片上有没有气泡产生?再导线中间接入一个电流表,观察电流表指针是否偏转?1定义:将化学能转化为电能的装置叫原电池。2构成的条件(1)电极材料。两种活动性不同的金属或金属和其它导电性的非金属(或某些氧化物等);(2)两电极必须浸没在电解质溶液中;(3)两电极之间要用导线连接,形成闭合回路。3正负极的判断(失去电子的电极是负、极燃料永远是负极)(1)由两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。(注意:镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;若镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。)(2)根据外电路
2、电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。(3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。(4)根据原电池两极发生的化学反应判断:原电池中,负极发生氧化反应,正极发生还原反应。因此可以根据总化学方程式中化合价的升降来判断。(5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。(6)根据电极上产生的气体判断:原电池工作后,如果某电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。(7)根据某电极附近pH的变化判断:析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。3电极反应式的书写(1)准确判断原电池的正负极是书写电极反应的关键,如果原电池的正负极判断失误,电极反应式的书写一定错误。上述判断正负极的方法是一般方法,但不是绝对的,例如铜片和铝片同时插入浓硝酸
3、溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:负极:Cu 2e Cu2正极:NO3 + 4H + 2e 2H2O + 2NO2再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为:负极:2Al + 8OH23e 2AlO2 + 2H2O正极:6H2O + 6e 6OH + 3H2(2)要注意电解质溶液的酸碱性在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH,在碱溶液中,电极反应式中不能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以CO32离子形式存在,而不是放出CO2气体。(3)要考虑电子的转移数目在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。(4)要利用总的反应方程式从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。例题1.CH
4、3OH和O2在KOH溶液中组成燃料电池,该电池的负极反应式为 。解析:第一步:找氧化还原反应中的对应关系:氧化剂还原产物;还原剂氧化产物,在负极反应。即:负极:CH3OH(还原剂) CO32 (氧化产物)第二步:分析电子转移的物质的量,CH3OH中碳元素为2价,CO32中碳元素为+4价,1 mol CH3OH转移6 mol电子。即负极:CH3OH CO32 + 6e第三步:依据电荷原理配平以上电极反应式,缺少的物质从反应介质中寻找。因为该电池为碱性电池,而且左右相差8 mol负电荷,所以应该在左边添加8 mol OH。即:负极:CH3OH + 8OH = CO32 + 6e第四步:OH或H+ 与H2O为对应关系,即一边有OH或H+,则另一边有H2O。所以负极反应式为:CH3OH + 8OH = CO32- + 6e + 6H2O或CH3OH6e+ 8OH = CO32 + 6H2O例2.(2011广东高考)某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )。A. a和b不连接时,铁片上会有金属铜析出B. a和b用导线连接时,铜片上发生的反应为:Cu2 + 2e = CuC.
《电化学基础专题复习打印稿教师MicrosoftW》由会员大米分享,可在线阅读,更多相关《电化学基础专题复习打印稿教师MicrosoftW》请在金锄头文库上搜索。

景阳亲子趣味游戏活动方案.doc

2023年五三转化纪困生心得体会.docx
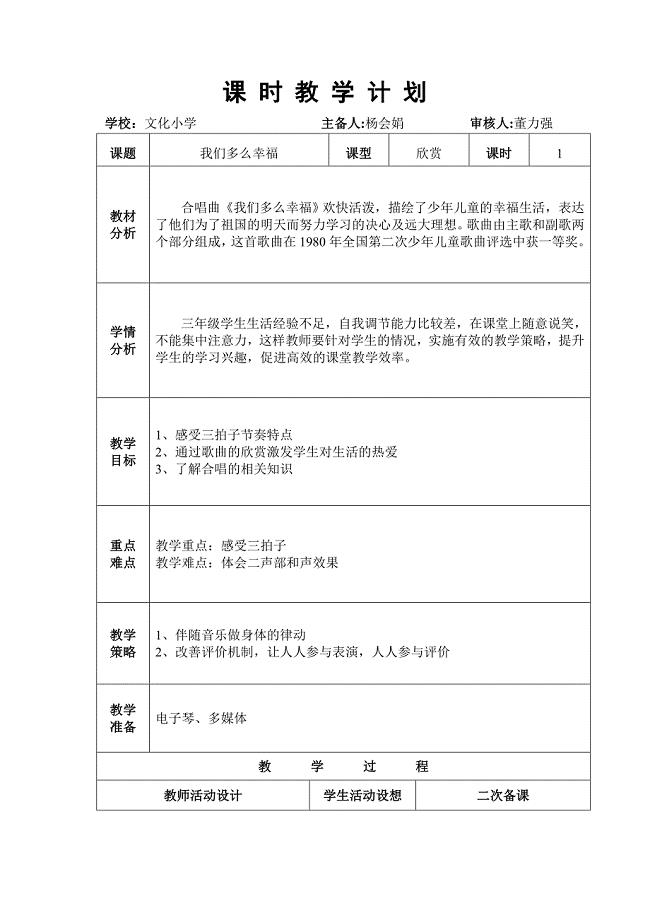
第一课《我们多么幸福》.doc

学校”申报总结.docx

第04章 综合指标.doc

填料装填安装施工方案.doc
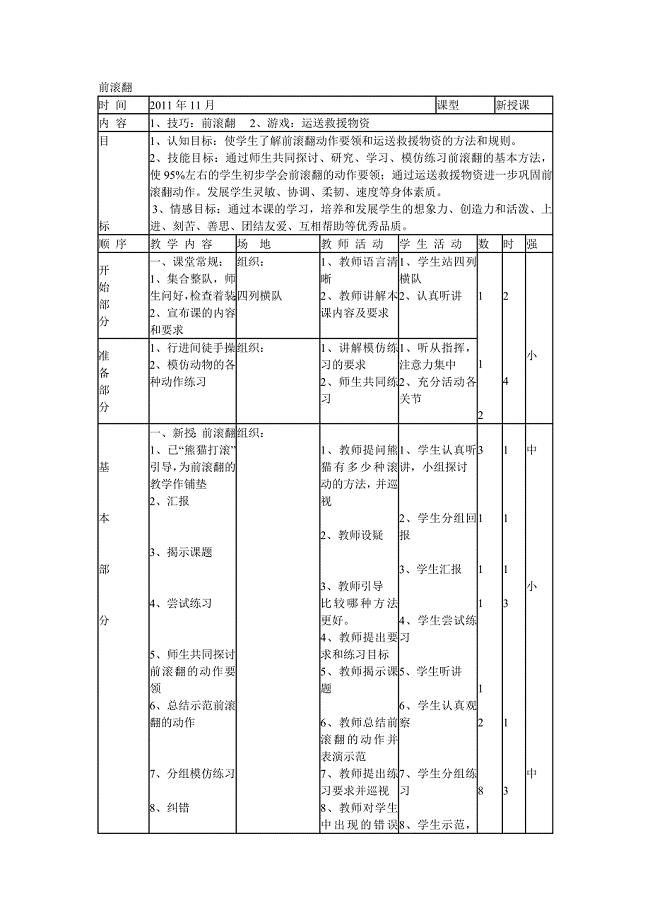
前滚翻教案 (2).doc

三峡库区草食牲畜发展现状及对策.doc

脚手架租赁协议标准版(9篇)

监测工作计划汇总8篇

2011年旅游示范县建设工作进展情况.doc

2023年中考语文总结交流.doc

股票周末祝福短信.docx

生产文员试用期总结参考范本(5篇).doc

湖北荆门市掇刀区司法局招考聘用司法所辅助人员笔试题库含答案详解析

S实业部人事管理流程.doc

2023年领班竞聘演讲稿43范文.docx

办公室租赁合同参考样本(6篇).doc

安全生产责任制与目标考核制度.docx

百鸟朝凤观后感15篇
 2023幼儿园大班安全计划范文(四篇)
2023幼儿园大班安全计划范文(四篇)
2022-12-28 11页
 2023年的骨干教师培训计划标准模板(4篇).doc
2023年的骨干教师培训计划标准模板(4篇).doc
2024-01-09 11页
 大班下半年教学工作计划(2篇).doc
大班下半年教学工作计划(2篇).doc
2023-11-27 6页
 2022年中小学卫生工作计划
2022年中小学卫生工作计划
2023-03-05 2页
 药房人员工作计划范文
药房人员工作计划范文
2023-06-02 3页
 幼儿园学前班体育教案:青蛙捉害虫
幼儿园学前班体育教案:青蛙捉害虫
2023-08-15 8页
 2022年自荐信物业管理专业
2022年自荐信物业管理专业
2022-10-18 1页
 2023年云南玉溪通海县教育系统提前招聘高中教师启事-云南玉溪通海地震
2023年云南玉溪通海县教育系统提前招聘高中教师启事-云南玉溪通海地震
2023-01-06 5页
 六年级暑假学习计划模板(4篇)
六年级暑假学习计划模板(4篇)
2023-12-29 9页
 【精选】高一数学人教A版必修1单元测评五:第一章集合与函数概念 Word版含解析
【精选】高一数学人教A版必修1单元测评五:第一章集合与函数概念 Word版含解析
2023-02-06 6页

