
物质的分类及其性质
4页1、物质的分类及其性质无机化合物分类:1氧化物酸性氧化物(C02、S02、S03、N2O5、Mn2O7、CrO3 等)(2) 碱性氧化物( Na2O、 CaO、 K2O、 Fe2O3、 CuO、 MgO 等)(3) 两性氧化物( Al2O3、 ZnO、 BeO 等)(4) 不成盐氧化物( CO、 NO 等)过氧化物(Na2O2、H2O2等)(6)特殊氧化物(Fe3O4、Pb3O4、K02、KO3 等)2酸(1)按酸根分1含氧酸:H2SO4、HNO3、H3PO4、HCIO4 等无氧酸:HC1、HF、HBr、H2S 等-一元酸:HC1、HNO3、HC10、HCIO4、HBr、HI 等按 H+数分一二元酸:H2SO4、H2CO3、H2SO3、H2S、H2SiO3 等 三元酸:h3po4强酸:H2SO4、HNO3、HCIO4、HBr、HI、HCl 等按强弱分-中强酸:H2SO3 H3PO4弱酸:HF、H2S、H2CO3、H2SiO3、HClO 等按氧化性分J氧化性酸:H2SO4 (浓)、HNO3、HC1O、HMnQ等7L 还原性酸:H2SO3、HBr、HI、H2C2O4(草酸)等(5)按沸点分 J
2、 挥发性酸:H2CO3、H2SO3、HNO3、HCl、HBr、HI 等 八刀1难挥发性酸:H2SO4、H3PO4等(6)按稳定性分-稳定性酸:H2SO4、H3PO4等3碱(1) 按性质分一(2) 按 0H-数分L 不稳定性酸:h2co3、H2SO3、HNO3、HClO 等 强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2 等弱碱:nh3h2o一元碱:NaOH、KOH、LiOH 等二元碱:Ba(OH)2、Ca(OH)2、Cu(OH)2、Mg(OH)2 等多元碱:Al(OH)3、Fe(OH)3 等 可溶性碱:NaOH、KOH、Ba(OH)2 等(3)按溶解性分微溶性碱:Ca(OH)2难溶性碱:Cu(OH)2、Mg(OH)2、Al(OH)3、Fe(OH)34.盐(1)按组成分正盐:Na2SO4、Na3PO4、Na2CO3、Na2SO3 等 酸式盐: NaHCO3、 NH4HCO3、 Ca(HCO3)2、 NaHSO3 碱式盐:Cu2(OH)2CO3等复盐:KA1(SO4)212H2O 等NaH2PO4 等(2)按酸根分-络盐:Ag(NH3)2OH、Fe(SCN)3 等含氧酸盐:Na2S
3、O4、Na2CO3、Na2SO3 等 无氧酸盐:、 MgCl2、 AlCl3、 Na2S 等强酸强碱盐:(3)按形成分-强酸弱碱盐:强碱弱酸盐:弱酸弱碱盐:Na2SO4、 NaCl 等AICI3、FeCl3、Fe2(SO4)3、NH4Cl 等Na2CO3、Na2SO3 等(NH4)2CO3、CH3COONH4 等其他J无机盐:nh4ci-有机盐:CH3COONa、C2H5ONa、C6H5ONa 等5特殊化合物J氢化物:口乩血氐比、肌比等5.特殊化口物碳化物:cac2、A14C3、SiC等氮化物:Mg3N2、AIN、Si3N4 等二物质的性质1酸性氧化物的性质:与碱反应只生成盐和水的是氧化物。(1)与水快速化合,并生成稳定的酸:SO3+ H2O = H2SO4P2O5 + 10(冷)=2HPO3(偏磷酸)P2O5 + 10(热)=2H3PO4 (磷酸)(2)与水化合是可逆的,并生成不稳定的酸亠 H2CO3so2+ h2o 一占 H2SO3(3) 不溶于水也不与水反应: Si02(4) 与碱反应:C02 + Ca(OH)2= CaCO3J+H2O 若氧化物过量,可继续反应: CaC03 +
《物质的分类及其性质》由会员博****1分享,可在线阅读,更多相关《物质的分类及其性质》请在金锄头文库上搜索。

7BUnit4Reading2教案

财务管理年度个人工作总结范文.docx

八年级英语上册Unit1Topic3教案(田天慧).doc

广东离婚协议书范文(九篇).doc

文明礼仪主题演讲稿范文【五篇】-.docx

机房接地方案

2023年刍议美国数字经济的制度要素.docx

山西省安全工程师安全生产:吊篮脚手架配重要求试题

健康饮茶避免几个坏习惯.doc

新任经理人的方法企业.doc

会计从业资格考试考前串讲笔记
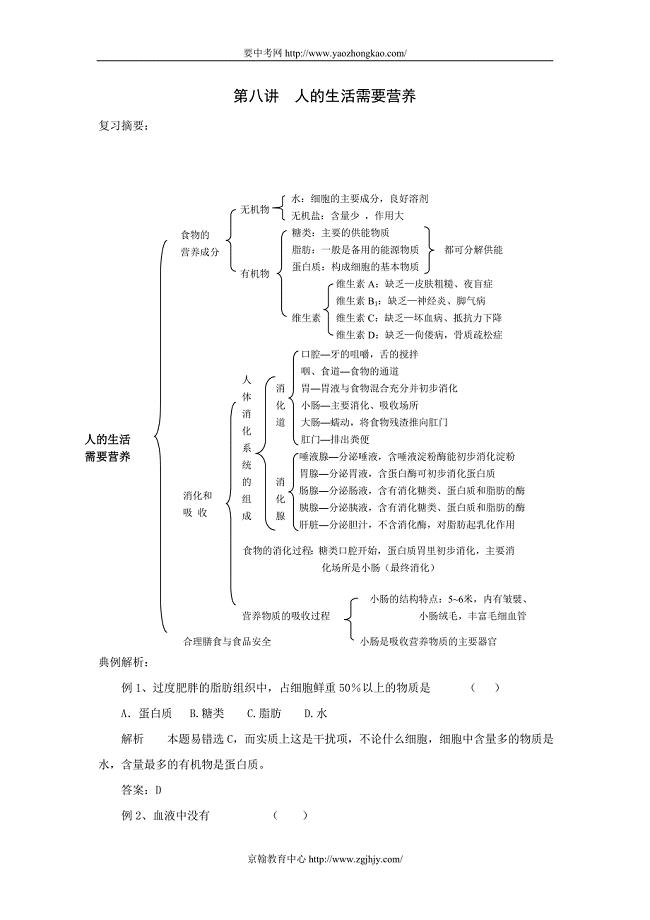
2010届中考生物人的生活需要营养复习题.doc

果糖、半乳糖、乳糖在动植物细胞的分布状态

奥曲肽对ERCP术后高淀粉酶血症及胰腺炎的预防疗效.docx

钟落潭小学二00九学年度第二学期音乐科工作计划

人教版五年级科学(上册)期中试题及答案(最新).doc

幽默搞笑短信,有些好笑的信息.doc

高速公路安全驾驶技巧.doc

药品安全知识宣传资料.doc

2022年自荐信物业管理专业
 果树栽培学
果树栽培学
2022-07-20 9页
 小型超声波切割机毕业设计论文
小型超声波切割机毕业设计论文
2024-02-22 41页
 石油测试工岗位职责
石油测试工岗位职责
2024-02-13 30页
 安全防护技术交底
安全防护技术交底
2022-11-13 4页
 葡萄糖氧化酶法的实验报告
葡萄糖氧化酶法的实验报告
2023-11-01 9页
 四川师范大学校徽校标
四川师范大学校徽校标
2023-10-15 2页
 简单个人车辆租赁合同模板(11篇)
简单个人车辆租赁合同模板(11篇)
2024-02-12 28页
 大型商场收银系统断网应急处置预案
大型商场收银系统断网应急处置预案
2023-04-21 3页
 煤矿装卸过程中的粉尘防治技术
煤矿装卸过程中的粉尘防治技术
2024-02-09 12页
 9 物体振动实验
9 物体振动实验
2022-11-10 4页

