
高中复习资料:化学13大类高频考点
10页1、氧化物的分类1氧化物的分类:成盐氧化物:酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物(过氧化物、超氧化物、Fe3O4、Pb3O4等);不成盐氧化物:CO、NO2易混淆概念分辨酸酐不一定是酸性氧化物:如乙酸酐酐(CH3CO)2O等;酸性氧化物一定是酸酐。非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3金属氧化物不一定是碱性氧化物:如Al2O3、ZnO(两性),Mn2O7、CrO3(酸性氧化物)碱性氧化物一定是金属氧化物NO2因与碱反应不仅生成盐和水,还有NO,因而不是酸性氧化物。Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化物。具有漂白作用的物质氧化作用:Cl2、O3、Na2O2、浓HNO3;化学变化;不可逆化合作用:SO2;化学变化;可逆吸附作用:活性炭;物理变化;可逆其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2能被活性炭吸附的物质1、有毒气体(NO2、Cl2、NO等)去毒;2、色素漂白;3、水中有臭味的物质净化“黑色金属”有哪些化学上把铁、铬、锰三种金属和
2、铁基合金统称为“黑色金属”。Fe2+与Fe3+的鉴别方法Fe2+与Fe3+的性质不同而又可以相互转化。中学化学中可用以下几种方法加以鉴别1观察法:其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+。2H2S法:通往H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3+,而Fe2+溶液 不反应。2Fe3+H2S=2Fe2+2H+S3KSCN法:加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3+溶液,而Fe2+的溶液无此现象。这是鉴别鉴别Fe3+与Fe2+最常用、最灵敏的方法。Fe3+SCN=Fe(SCN)2+4苯酚法:分别加入苯酚溶液,显透明紫色的是Fe3+溶液,无此现象的是Fe2+的溶液。Fe3+6C6H5OHFe(C6H5O)636H+(了解)5碱液法:取两种溶液分别通入氨气或碱液,生成红褐色沉淀的是Fe3+溶液,生成白色沉淀并迅速变为灰绿色、最终变成红褐色的是Fe2+溶液。Fe3+3NH3H2O=Fe(OH)33NH4+;Fe3+3OH= Fe(OH)3Fe2+2 NH3H2O=Fe(OH)22NH4+ ;4 Fe(OH)22H2OO2=4 Fe(OH)36淀粉KI试纸法:能使
3、淀粉KI试纸变蓝的是Fe3+溶液,无变化的是Fe3+溶液。2 Fe3+2I=2 Fe2+I27铜片法:分别加入铜片,铜片溶解且溶液渐渐变为蓝色的是Fe3+溶液,无明显现象的是Fe2+溶液。2 Fe3+Cu=2 Fe2+Cu2+8KMnO4法:分别加入少量酸性KMnO4溶液,振荡,能使KMnO4溶液紫红色变浅的是Fe2+溶液,颜色不变浅的是Fe3+溶液。5 Fe2+MnO48H+=5 Fe3+Mn2+4H2O金属的冶炼规律1活泼金属的冶炼钠、镁、铝等活泼金属,采用电解其熔融态的卤化物的方法冶炼(通直流电)。例如:2NaCl(熔融) 2NaCl2 MgCl2熔融) MgCl22Al2O3(熔融) 4Al3O2(加入Na3AlF6作熔剂)注:这里为何不电解熔融态铝的氯化物而须电解其熔融态的氧化物,读者应掌握AlCl3为共价化合物,熔融态时不电离,而Al2O3为离子化合物,熔融态时可发生电离的道理。2中等活泼的金属的冶炼锌、铁、锡、铅等中等活泼的金属采用还原剂还原它们的氧化物的方法冶炼。例如:ZnOC ZnCOFe2O33CO 2Fe3CO2WO33H2 W3H2OCr2O32Al 2CrAl
《高中复习资料:化学13大类高频考点》由会员小****分享,可在线阅读,更多相关《高中复习资料:化学13大类高频考点》请在金锄头文库上搜索。

人教版九年级全册英语单元短语句型汇总

初中复习资料:英语构词法整理
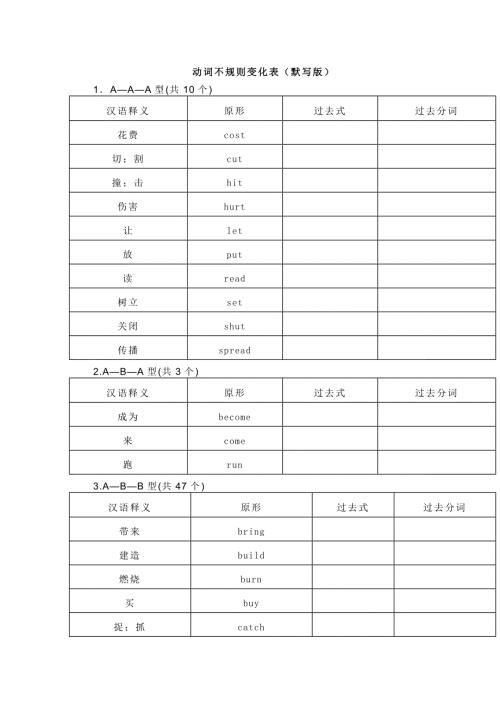
初中英语不规则动词表(含背诵版和默写版)

初中复习资料:英语核心句型

新目标八年级英语(下册)Units1-10 重点内容归纳

初中英语语法精讲+精练-人称代词、物主代词和指示代词

初中英语必考的核心短语

初中英语语法精讲+精练-非谓语动词

初中英语有关时间、星期、月份、节日的英语分类
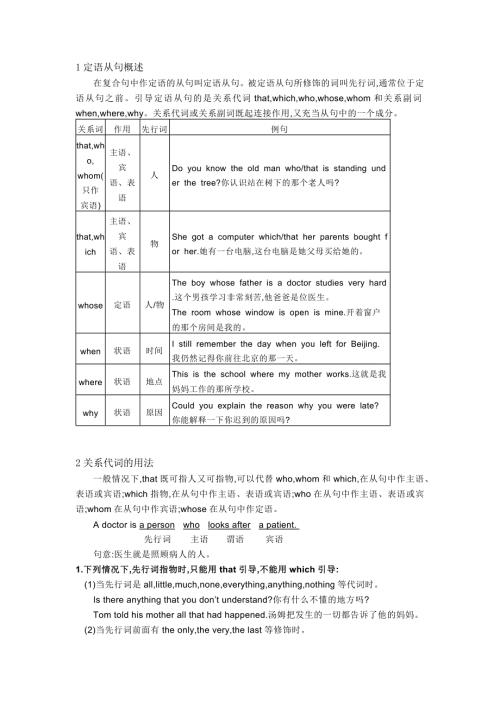
初中英语语法精讲+精练 定语从句

人教版八年级英语下册单词拓展

外研版七年级英语(下册)Module 4 随堂检测含答案

新目标七年级英语(下册)Units1-12 重点内容归纳

初中英语语法真题14:宾语从句

新目标七年级英语(上册)Unit 5 必考知识点

初中英语常见语法错误100个

外研版七年级英语(下册)Module 1 随堂检测含答案

新目标英语九年级Unit 3 单元检测+答案解析
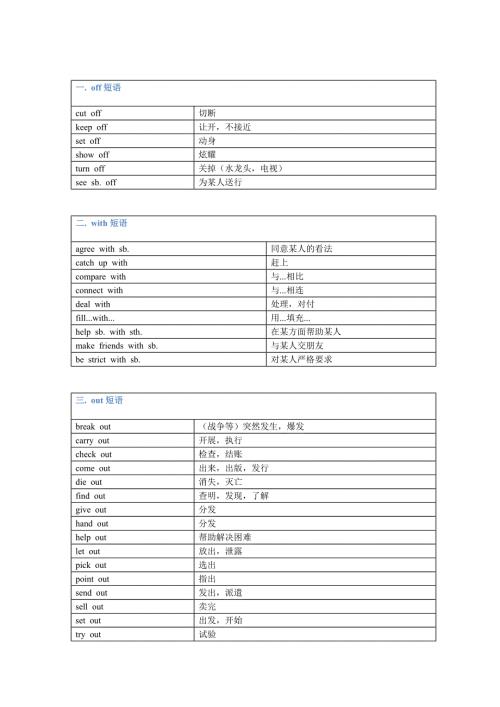
初中英语必背的分类短语

初中9年级英语上下全册短语汇总整理
 2021年下半年体育学科教研工作计划.doc
2021年下半年体育学科教研工作计划.doc
2023-01-12 4页
 银行营业部上半年反洗钱工作报告
银行营业部上半年反洗钱工作报告
2023-10-25 3页
 七年级上册历史时间轴
七年级上册历史时间轴
2023-02-01 4页
 美的空调售后服务管理信息系统建设
美的空调售后服务管理信息系统建设
2023-02-01 43页
 Unit 9 Lesson 3 The Secrets of Your Memory 课文配套练习 高中英语北师大版(2019)必修第三册.docx
Unit 9 Lesson 3 The Secrets of Your Memory 课文配套练习 高中英语北师大版(2019)必修第三册.docx
2023-02-07 3页
 不同函数增长的差异同步练习 高一上学期数学人教A版(2019)必修第一册.docx
不同函数增长的差异同步练习 高一上学期数学人教A版(2019)必修第一册.docx
2023-02-05 6页
 2021年新高考I卷重点词汇知识清单 高三英语二轮专题 .docx
2021年新高考I卷重点词汇知识清单 高三英语二轮专题 .docx
2024-01-12 8页
 总体取值规律的估计 同步练习 高一下学期数学人教A版(2019)必修第二册.docx
总体取值规律的估计 同步练习 高一下学期数学人教A版(2019)必修第二册.docx
2023-03-28 9页
 奇偶性教学设计 高一上学期数学人教A版(2019)必修第一册.docx
奇偶性教学设计 高一上学期数学人教A版(2019)必修第一册.docx
2023-09-28 4页
 2020届高考语文模拟竞优卷 第五卷(含答案).doc
2020届高考语文模拟竞优卷 第五卷(含答案).doc
2023-08-07 19页

