
高一化学科目知识点下学期
7页1、高一化学科目知识点下学期1.高一化学科目知识点下学期 篇一物质的量的单位摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。2.摩尔(mol):把含有6.021023个粒子的任何粒子集体计量为1摩尔。3.阿伏加德罗常数:把6.02X1023mol-1叫作阿伏加德罗常数。4.物质的量=物质所含微粒数目/阿伏加德罗常数n=N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol或g.mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量(n=m/M)2.高一化学科目知识点下学期 篇二混合物的分离和提纯分离和提纯的方法,分离的物质,应注意的事项,应用举例过滤,用于固液混合的分离,一贴、二低、三靠,如粗盐的提纯蒸馏,提纯或分离沸点不同的液体混合物,防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向,如石油的蒸馏萃取,利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法,选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要
2、远大于原溶剂,用四氯化碳萃取溴水里的溴、碘分液,分离互不相溶的液体,打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出,如用四氯化碳萃取溴水里的溴、碘后再分液蒸发和结晶,用来分离和提纯几种可溶性固体的混合物,加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热,分离NaCl和KNO3混合物3.高一化学科目知识点下学期 篇三富集在海水中的元素氯1、氯气是黄绿色气体,实验室制取的离子方程式为MnO2+4H+2Cl-Mn2+Cl2+2H2O,这里MnO2是氧化剂,Cl2是氧化产物。2、实验室制得的氯气一定含有HCl和水蒸气,必须先通过饱和食盐水溶液再通过浓硫酸,就可以得到干燥纯净的氯气。3、铁和Cl2反应方程式为2Fe+3Cl22FeCl3,H2点燃后放入Cl2中,现象是:安静燃烧,苍白色火焰,瓶口有白雾,这是工业制盐酸的主反应。4、Cl2溶于水发生反应为Cl2+H2O=HCl+HClO,氯水呈黄绿色是因为含Cl2,具有漂白杀菌作用是因为含有次氯酸,久置的氯水会变成稀盐酸。5、氯水通
3、入紫色石蕊试液现象是先变红后褪色,氯气通入NaOH溶液中可制漂白液,有效成分为NaClO,通入Ca(OH)2中可生成漂白粉或漂粉精。6、检验溶液中的Cl-,需用到的试剂是,AgNO3溶液和稀HNO3。4.高一化学科目知识点下学期 篇四氧化还原反应1、氧化还原反应的本质是有电子的转移,氧化还原反应的特征是有化合价的升降。2、失去电子(偏离电子)化合价升高被氧化是还原剂;升价后生成氧化产物。还原剂具有还原性。得到电子(偏向电子)化合价降低被还原是氧化剂;降价后生成还原产物,氧化剂具有氧化性。3、常见氧化剂有:Cl2、O2、浓H2SO4、HNO3、KMnO4(H+)、H2O2、ClO-、FeCl3等,常见还原剂有:Al、Zn、Fe;C、H2、CO、SO2、H2S;SO32-、S2-、I-、Fe2+等4、氧化还原强弱判断法知反应方向就知道“一组强弱”金属或非金属单质越活泼对应的离子越不活泼(即金属离子氧化性越弱、非金属离子还原性越弱)浓度、温度、氧化或还原程度等也可以判断(越容易氧化或还原则对应能力越强)。5.高一化学科目知识点下学期 篇五1、物理性质:无色、无味的气体,极难溶于水,密度小于空
4、气,俗名:沼气、坑气2、分子结构:CH4:以碳原子为中心,四个氢原子为顶点的正四面体(键角:109度28分)3、化学性质:氧化反应:(产物气体如何检验?)甲烷与KMnO4不发生反应,所以不能使紫色KMnO4溶液褪色取代反应:(三氯甲烷又叫氯仿,四氯甲烷又叫四氯化碳,二氯甲烷只有一种结构,说明甲烷是正四面体结构)4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物)5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同)烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低同分异构体书写:会写丁烷和戊烷的同分异构体6.高一化学科目知识点下学期 篇六一、物质燃烧时的影响因素:氧气的浓度不同,生成物也不同。如:碳在氧气充足时生成二氧化碳,不充足时生成一氧化碳。氧气的浓度不同,现象也不同。如:硫在空气中燃烧是淡蓝色火焰,在纯氧中是蓝色火焰。氧气的浓度不同,反应程度也不同。如:铁能在纯氧中燃烧,在空气中不燃烧。物质的接触面积不同,燃烧程度也不同。如:煤球的燃烧与蜂窝煤的燃烧。二、影响物质溶解的
《高一化学科目知识点下学期》由会员以***分享,可在线阅读,更多相关《高一化学科目知识点下学期》请在金锄头文库上搜索。

小学数学十以内的加减法教案

五年级上册落花生知识点归纳

临沧云县教师考试小学招聘教师资格证《中学综合素质》 考试测试试题及答案

建筑联营合作协议书

上海松江区招聘教师资格证《中学教育教学知识与能力》 编制考试教师模拟测试题

试卷解析山东枣庄市峄城区荀子学校七年级下学期第一次月考历史试题-(含参考答案)

2024年上海高考化学模拟试卷及答案

蚌埠龙子湖区教师招聘教师资格证《中学综合素质》试题 含答案

五年级下册语文知识点整理归纳

一年级口算题 (整数)30以内加法第81-100篇

初三物理第一单元测试题及答案

分家赡养老人的协议书

徐州云龙区教师招聘教师资格证《中学教育教学知识与能 力》考试综合模拟试卷及答案

2024年中学教师资格证考试《教育知识与能力》真题及 参考答案

孝感云梦县教师招聘教师资格证《中学教育教学知识与能力》考试试卷及答案(全真模拟)

试卷解析山东淄博市周村区第三中学(五四学制)八年级月考历史试题-(含参考答案)

高二上学期第一次五校联考政治试题
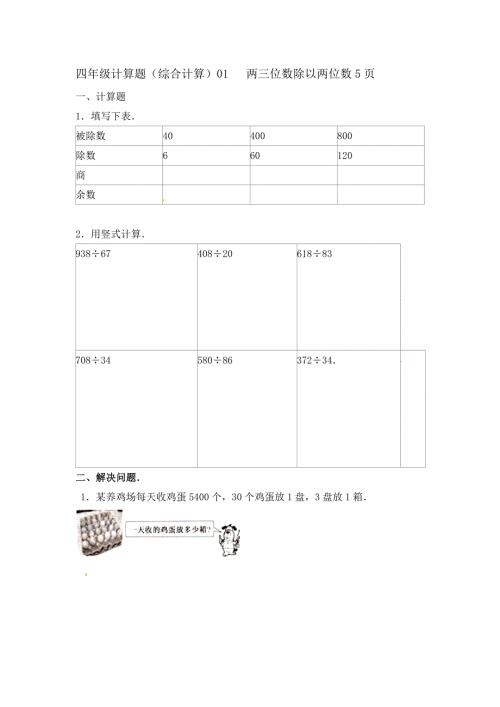
四年级计算题(综合计算)01 两三位数除以两位数5页

中小学教师资格证结构化考试题目含标准答案

四年级语文下册四年级《第一朵杏花》教学分析
 小学四年级音乐《我们的田野》课件配套教案.doc
小学四年级音乐《我们的田野》课件配套教案.doc
2023-09-13 4页
 有几棵树教学设计.doc
有几棵树教学设计.doc
2023-12-16 3页
 (完整word版)高中英语阅读之推理判断题的解题技巧.doc
(完整word版)高中英语阅读之推理判断题的解题技巧.doc
2023-07-16 5页
 《一元一次方程》全章复习与巩固(提高)巩固练习.doc
《一元一次方程》全章复习与巩固(提高)巩固练习.doc
2022-10-02 4页
 导之有方读之有法.doc
导之有方读之有法.doc
2022-09-27 4页
 奥巴马胜选连任演讲.doc
奥巴马胜选连任演讲.doc
2023-05-11 7页
 幼儿园教学周总结7篇.docx
幼儿园教学周总结7篇.docx
2023-02-25 13页
 中考英语词组总结计划.doc
中考英语词组总结计划.doc
2023-02-04 17页
 关于噪音实验报告模板.docx
关于噪音实验报告模板.docx
2022-12-24 6页
 立定跳远教案.doc
立定跳远教案.doc
2023-12-24 3页

