
医疗器械生产许可证变更
10页1、38-9-02 医疗器械生产许可证许可事项变更(增加生产产品或生产地址非文字性变更)发布时间:2014-10-01许可项目名称:医疗器械生产许可证许可事项变更(增加生产产品或生产地址非文字性变更)编号:38-9-02法定实施主体:北京市食品药品监督管理局(委托区县局、直属分局)依据: 医疗器械生产监督管理办法(国家食品药品监督管理总局令第7号第十四条、第十五条)收费标准:不收费期限:自受理之日起30个工作日(不含送达期限)受理2个工作日审核22个工作日复审3个工作日审定3个工作日受理范围:由企业工商注册所在地的区县食品药品监督管理局或北京市食品药品监督管理局直属分局办理。企业变更住所应向变更后工商注册所在地的区县食品药品监督管理局或北京市食品药品监督管理局直属分局申请。企业同时申请医疗器械生产许可证变更企业名称、法定代表人、企业负责人、住所、生产地址文字性变更、减少生产产品的,应按照本程序合并办理,对于合并办理程序,应提交合并后所需相关材料。许可程序:一、申请与受理申请医疗器械生产许可证许可事项变更的基本条件:1.已取得第二、三医疗器械产品注册证书,已按照有关规定取得企业工商登记;2.
2、已具备拟生产产品的生产能力;已按照医疗器械生产质量管理规范的要求建立医疗器械生产质量管理体系;3.办理医疗器械生产许可申请的人员具有相应的专业知识,熟悉医疗器械生产质量管理的法规、规章和技术要求;申请人登陆北京市食品药品监督管理局企业服务平台进行网上申报,根据受理范围的规定,需提交以下申请材料:1、医疗器械生产许可变更申请表;2、医疗器械生产许可证(含医疗器械生产产品登记表)或医疗器械生产企业许可证正副本复印件;3、 企业变更的情况说明;4、申请材料真实性的自我保证声明,包括企业对材料作出如有虚假承担法律责任的承诺;5、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人的,企业应当提交授权委托书。增加生产产品的,还应提交:(1)增加的所生产医疗器械的注册证及产品技术要求复印件; (2)主要生产设备和检验设备目录;(3)所生产产品的工艺流程图,并注明主要控制项目和控制点,包括关键和特殊工序的设备、人员及工艺参数控制的说明;如增加产品为受托生产,还需提交:(1)委托方和受托方营业执照、组织机构代码证复印件;(2)受托方医疗器械生产许可证复印件;(3)委托方医疗器械委托生产备案凭证复印
3、件;(4)委托生产合同复印件;(5)委托生产医疗器械拟采用的说明书和标签样稿;(6)委托方对受托方质量管理体系的认可声明;(7)委托方关于委托生产医疗器械质量、销售及售后服务责任的自我保证声明;生产地址非文字性变更的,还应提交: (1)生产场地的证明文件(规划用途或设计用途不应该为“住宅”),包括租赁协议、房产证明(或使用权证明)的复印件;厂区位置路线图、厂区总平面图、主要生产车间布置图,有洁净要求的车间,须标明功能间及人流、物流走向同时提供洁净室的合格检测报告复印件(检测报告应是由省级食品药品监督管理部门认可的检测机构出具的一年内的符合无菌医疗器具生产管理规范(YY0033)的合格检测报告);(2)所生产产品的工艺流程图,并注明主要控制项目和控制点,包括关键和特殊工序的设备、人员及工艺参数控制的说明;如企业同时变更企业名称、法定代表人、企业负责人、住所或生产地址文字性变更的,应按照本程序合并办理,并还应提交以下申请材料:变更企业名称,应提交:工商行政管理部门出具的企业名称变更核准通知书和变更后的营业执照副本复印件;变更住所、法定代表人的,应提交:(1)工商行政管理部门出具变更后的营业
4、执照副本复印件;(2)变更法定代表人的需同时提交变更后法定代表人身份证明复印件;变更企业负责人的,应提交:变更后企业负责人的身份证明复印件;生产地址文字性变更的,应提交:生产地址文字性变更的相关证明文件;标准:1、申请材料应完整、清晰,要求签字的须签字,每份加盖企业公章。使用A4纸打印或复印,装订成册;2、凡申请材料需提交复印件的,申请人须在复印件上注明日期,加盖企业公章;3、生产企业提交的医疗器械生产许可变更申请表应有法定代表人签字并加盖企业公章;4、医疗器械生产许可变更申请表所填写项目应填写齐全、准确,填写内容应符合以下要求:企业名称、法定代表人、住所应与变更后营业执照相同;5、增加生产产品或生产地址非文字性变更:(1)企业提交的注册证应在有效期内;(2)包括租赁协议、房产证明(或使用权证明)应有效;(3)无菌医疗器械生产环境检测报告应有效;6、变更企业名称、法定代表人、企业负责人、住所或生产地址文字性变更时:法定代表人、企业负责人的身份证明文件应有效;7、申请材料真实性的自我保证声明应有法定代表人签字并加盖企业公章。岗位责任人:区县局或直属分局受理人员岗位职责及权限:1、按照标准
《医疗器械生产许可证变更》由会员cl****1分享,可在线阅读,更多相关《医疗器械生产许可证变更》请在金锄头文库上搜索。

导学案五柳先生传

2018年单证员年终工作总结.doc

2023年物业管理年度工作总结(4篇).doc

计划员岗位责任制

护士正规辞职申请书模板.doc

理想领导者的特质(上)

服装店店长工作计划(6篇).doc

教师产假请假条(精选15篇).doc

安全生产学生实习心得5篇.doc

购物中心商户装修管理标准手册NXPowerLite

急性胃炎的原因

技能大赛领导总结讲话.doc

商场杀虫灭鼠方案

中考英语句子翻译精选89题

XX年3月寒假考研目的实践调查报告

室内设计毕业论文开题报告.docx
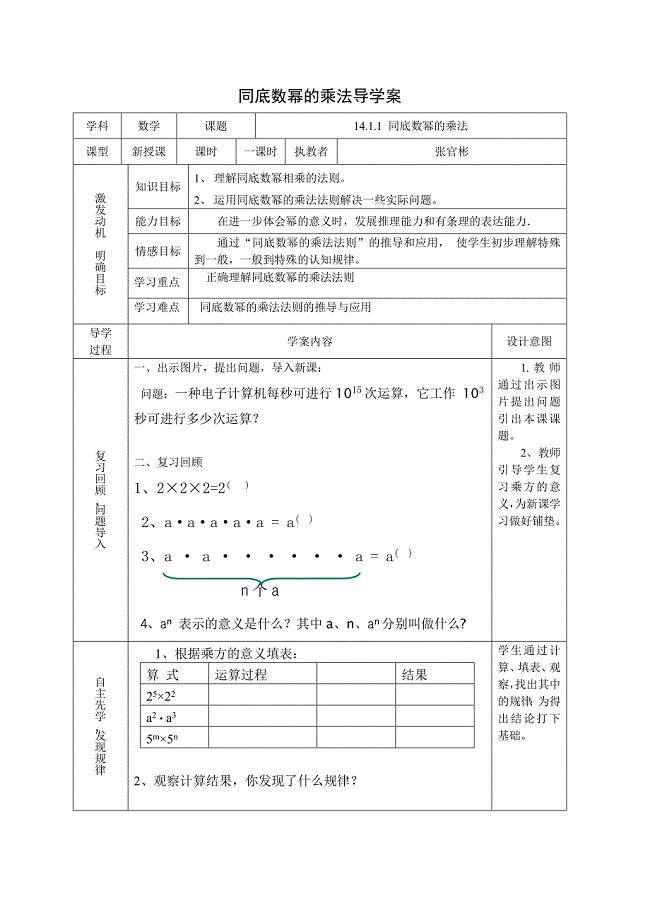
章前引言及同底数幂的乘法…18.doc

中国图书馆学会专业图书馆分会2017年学术年会

田园综合体模式最全解析
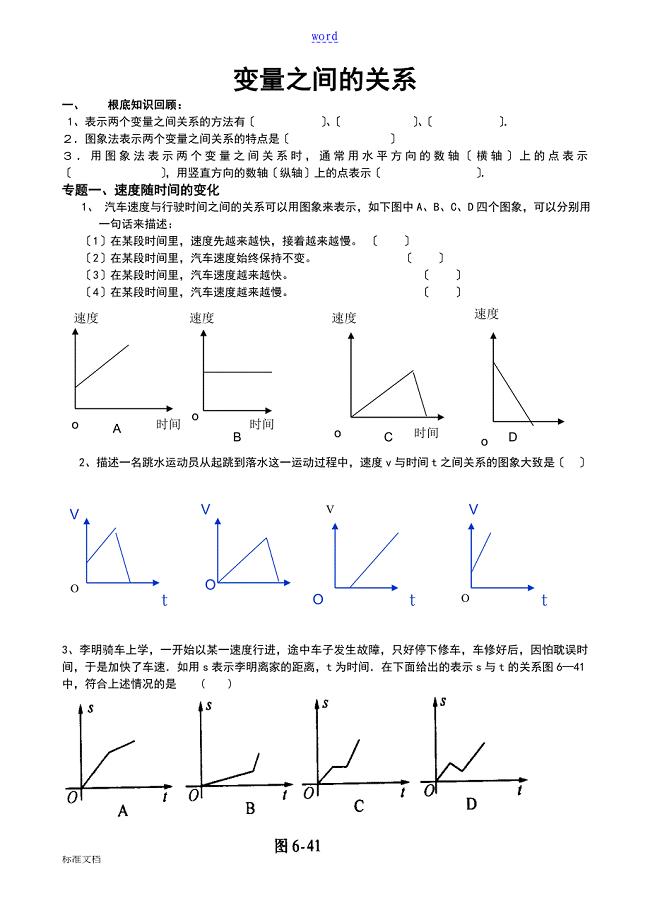
北师大版七年级数学下册变量之间地关系专题复习
 新版高考数学一轮复习选修部分坐标系与参数方程第1讲坐标系知能训练轻松闯关理北师大版选修4
新版高考数学一轮复习选修部分坐标系与参数方程第1讲坐标系知能训练轻松闯关理北师大版选修4
2023-04-07 4页
 高中数学北师大版必修五教案:2.2 典例例题:三角形中的有关问题
高中数学北师大版必修五教案:2.2 典例例题:三角形中的有关问题
2022-11-14 4页
 【最新版】九年级数学上册22.2一元二次方程的解法第3课时教案新版华东师大版
【最新版】九年级数学上册22.2一元二次方程的解法第3课时教案新版华东师大版
2023-04-30 4页
 毕业设计论文基于AT89C51单片机的简易计算器设计
毕业设计论文基于AT89C51单片机的简易计算器设计
2023-01-27 22页
 河北省围场县棋盘山中学九年级历史上册第11课英国资产阶级革命复习提纲新人教版
河北省围场县棋盘山中学九年级历史上册第11课英国资产阶级革命复习提纲新人教版
2023-05-09 1页
 案例2江苏省沿海地区发展规划文本图件
案例2江苏省沿海地区发展规划文本图件
2023-02-20 31页
 牛津译林版八年级上册Unit2Schoollife知识点精讲精练知识点配练习含答案2
牛津译林版八年级上册Unit2Schoollife知识点精讲精练知识点配练习含答案2
2023-06-03 29页
 公寓楼施工电梯卸料平台防护架体防护门搭设施工方案
公寓楼施工电梯卸料平台防护架体防护门搭设施工方案
2023-03-06 39页
 人教版小学数学五年级下册第二单元检测试卷因数与倍数
人教版小学数学五年级下册第二单元检测试卷因数与倍数
2023-01-12 4页
 精品第2节光的反射
精品第2节光的反射
2023-04-11 3页

