
四4氮及其重要化合物
20页1、-第四节 氮及其重要化合物【高考新动向】考点梳理1.了解氮单质及其重要化合物的主要性质及应用。2.了解氮单质及其重要化合物对环境质量的影响。【考纲全景透析】一、氮的单质及其氧化物1.氮在自然界中的存在与转化(1)氮元素的存在与氮的固定2氮气(1)物理性质颜色:无色;气味:无味;状态:气体;密度:比空气小;溶解性:难溶于水。(2)化学性质3.NO和NO2的性质比拟NONO2物理性质颜色无色红棕色毒性有毒有毒溶解性不溶能溶化学性质与O2反响2NOO2=2NO2与H2O反响3NO2H2O=2HNO3NO实验室制法(填化学方程式)3Cu8HNO3(稀)=3Cu(NO3)22NO4H2OCu4HNO3(浓)=Cu(NO3)22NO22H2O与人体、环境的关系与血红蛋白结合使人中毒转化成NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾二、氨和铵盐1氨气物理性质无色、刺激性气味的气体,密度比空气小,极易溶于水,常温常压下1体积水能溶解700体积的氨气,易液化可作致冷剂2. 氨气化学性质1与水反响:氨水呈碱性,原理:NH3+H2ONH3H2ONH4+OH-氨气是唯一能使湿润的红色石蕊试纸变蓝色的气体,常
2、用此性质检验氨气。2与酸反响与挥发性酸(如浓盐酸、硝酸)的反响NH3+HCl=NH4Cl现象:产生白烟与硫酸反响:2NH3+H2SO4=(NH4)2SO43与盐反响:向AlCl3溶液中滴加氨水反响的离子方程式为:Al3+3 NH3H2O=Al(OH)3+3 NH4+4氨气的复原性NH3中的N呈3价,所以NH3具有复原性,能被O2、CuO、NO*、Cl2等物质氧化。3.实验室制法:2NH4ClCa(OH)22NH3CaCl22H2O。4用途:制HNO3、铵盐、纯碱、尿素,制冷剂等。5.铵盐1物理性质:都是无色或白色晶体,易溶于水。2化学性质:不稳定性:NH4HCO3 NH3 + H2O + CO230以上可分解,NH4Cl NH3+ HCl与碱反响: a. 在稀溶液中不加热:b. b.加热时或浓溶液: 3NH4+的检验:取少量样品,与碱混合于试管中,加热。将湿润的红色石蕊试纸靠近管口,试纸变蓝色,说明样品中含有NH4+;也可以将蘸有浓盐酸的玻璃棒靠近管口,假设有白烟产生,说明样品中含有NH4+。未知液呈碱性湿润红色石蕊试纸变蓝色,则证明含NH。三、硝酸1、物理性质无色、易挥发在空气中遇水
3、蒸气呈白雾状,有刺激性气味的液体。2、化学性质1不稳定性市售浓硝酸呈黄色的原因是:硝酸分解生成的NO2溶解在硝酸里硝酸保存在棕色试剂瓶中,置于冷暗处,不能用橡胶塞。2强氧化性:硝酸无论浓、稀都有强氧化性,而且浓度越大氧化性越强能与Au、Pt以外的所有金属反响,如Cu与浓、稀硝酸的反响方程式:Cu+4HNO3(浓)= Cu(NO3)2+2NO2+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O注意:有些金属(如Al、Fe等)在冷的浓硝酸中发生钝化。故可以用铁、铝容器运输冷的浓硝酸。与非金属的反响碳与浓硝酸反响的化学方程式:C+4HNO3 CO2+4NO2+2H2O与*些复原性物质反响如FeO化学方程式:3FeO+ 10HNO3(稀)= 3Fe(NO3)3+NO+5H2O3、NO3离子的检验:晶体或浓溶液与浓硫酸、Cu共热时,假设产生红棕色气体则含NO3;假设为稀溶液则先浓缩。(3)与有机物反响硝化反响(与C6H6反响):C6H6+HNO3浓硫酸C6H5NO2+H2O颜色反响:蛋白质遇到浓硝酸时变黄色3. 用途:化工原料,用于制化肥、染料、炸药等。【热点难点全析】一
4、、氨气的实验室制法与性质1加热固态铵盐和碱的混合物(1)反响原理:2NH4ClCa(OH)22NH3CaCl22H2O。(2)装置:“固体固体气体(与用KClO3或KMnO4制O2的装置一样)。(3)收集:只能用向下排空气法。(4)枯燥:用碱石灰(NaOH和CaO固体的混合物)。(5)验满方法:用湿润的红色石蕊试纸置于试管口,试纸变蓝色;将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。(6)环保措施:收集时,一般在管口塞一团用水或稀硫酸浸湿的棉花球,可减小NH3与空气的对流速度,收集到纯洁的NH3,同时也可防止污染空气。2加热浓氨水(1)反响原理:NH3H2ONH3H2O。(2)装置:右图3浓氨水中加固态碱性物质(1)原理:浓氨水中存在以下平衡:NH3H2ONH3H2ONHOH,参加固态碱性物质(如CaO、NaOH、碱石灰等),使平衡逆向移动,促进了NH3H2O的分解。(2)装置:特别提醒加热铵盐和碱制氨气时:(1)不宜选用NH4NO3和NH4HCO3,NH4NO3受热易爆炸,NH4HCO3受热易分解产生CO2。(2)Ca(OH)2不宜用NaOH、KOH代替,原因是NaOH、KOH易吸湿,
《四4氮及其重要化合物》由会员pu****.1分享,可在线阅读,更多相关《四4氮及其重要化合物》请在金锄头文库上搜索。

有关尊老爱幼的演讲稿.docx

室内设计实习日记_1.docx

被视为生活中心的意式座椅演变过程史
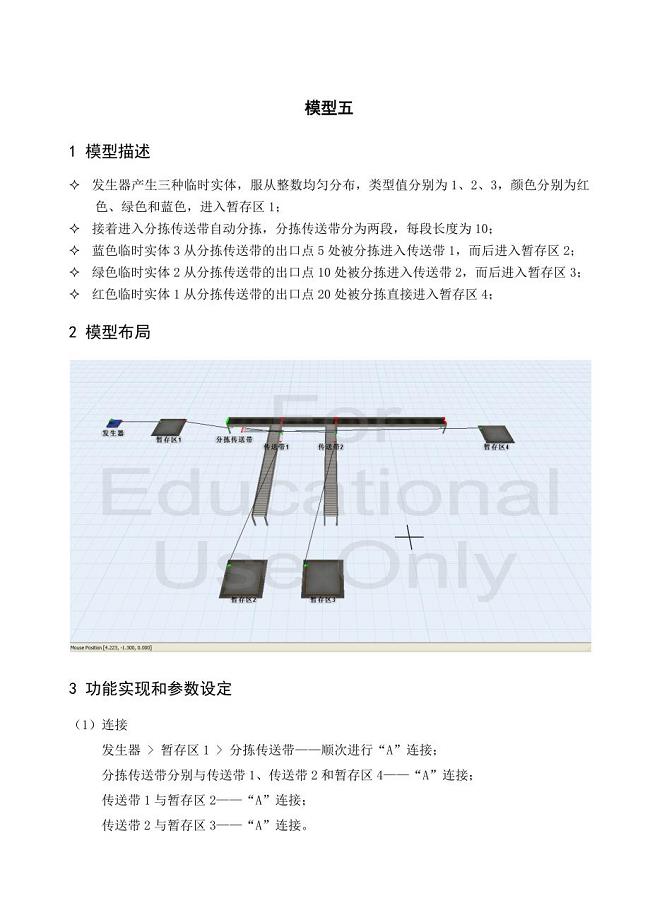
物流信息系统李荣情模型1-5.docx

火力发电厂湿烟囱防腐钛钢复合板内筒的施工

汽车电控发动机常见故障的原因分析及排除.docx

论学校体育人文素质教育.docx

旅游开发教学案例

交通监控工程投标书(1).docx

无创呼吸机临床应用护理体会.doc

人力资源控制程序7909.doc

物流管理之库存管理重点整理.docx

七年级数学下册 4.3 探索三角形全等的条件(2)导学案(新版)北师大版.doc

物业管理委托合同模板通用版

新学期高三班主任工作计划模板【五篇】范文

表面活性剂化学复习题

生物入侵对生态环境的影响及保护策略.doc

私营劳动合同完善企业内部规章制度.doc

医疗废物暂存点消毒隔离管理制度(8篇)

小学教育论文选题与书目【优质】.doc
 安全检查与隐患排查记录表
安全检查与隐患排查记录表
2023-01-22 21页
 生物2人教新课件1.2知能过关演练
生物2人教新课件1.2知能过关演练
2023-12-08 6页
 入院文献.doc
入院文献.doc
2023-04-29 4页
 基础护理试题.doc
基础护理试题.doc
2023-10-01 8页
 科学喝茶可有效防治脂肪肝
科学喝茶可有效防治脂肪肝
2023-01-01 2页
 4吨锅炉烟气馀热回收项目设计说明书
4吨锅炉烟气馀热回收项目设计说明书
2023-11-17 9页
 高一数学人教A版必修2单元检测第三章直线与方程含解析
高一数学人教A版必修2单元检测第三章直线与方程含解析
2023-09-24 4页
 【名校精品】数学中考:第六讲 第3课时 抛物线中的一个动点问题
【名校精品】数学中考:第六讲 第3课时 抛物线中的一个动点问题
2023-10-31 9页
 企业座谈会总结发言
企业座谈会总结发言
2023-08-14 9页
 微机系统与维护实训报告答案
微机系统与维护实训报告答案
2023-10-08 24页

