
精品高考化学二轮复习收尾练:物质结构与性质含新题详解
9页1、高考化学复习备考精品资料物质结构与性质1.(2013上海高考)下列变化需克服相同类型作用力的是()A碘和干冰的升华B硅和C60的熔化C氯化氢和氯化钠的溶解 D溴和汞的气化【解析】A项变化克服的都是分子间作用力,正确,硅和C60的熔化分别克服的是共价键、分子间作用力, B项错误;氯化氢和氯化钠的溶解分别克服的是共价键、离子键,C项错误;溴和汞的气化分别克服的是分子间作用力、金属键,D项错误。【答案】A2(2013雅安质检)下列说法正确的是()A原子核外电子层数越多,原子半径越大B每一主族所含非金属元素的种类可表示为族序数2C根据泡利原理将氧元素基态原子的电子排布图书写为DC2H2分子中的碳采取sp2杂化【解析】原子半径的影响因素除核外电子层数外,还有核电荷数,核电荷数越多,对核外电子的吸引力越大,半径越小,如锂原子半径比氯原子半径大,A项错;氧元素基态原子的电子排布图应该是,C项错;C2H2的结构式为HCCH,C采取sp杂化。【答案】B3(2012上海高考)PH3一种无色剧毒气体,其分子结构和NH3相似,但PH键键能比NH键键能低。下列判断错误的是()APH3分子呈三角锥形BPH3分子是
2、极性分子CPH3沸点低于NH3沸点,因为PH键键能低DPH3分子稳定性低于NH3分子,因为NH键键能高【解析】PH3同NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,故A、B项正确;PH3的沸点低于NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为NH键键能高,D项正确。【答案】C4(2013黄山质检)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=(NH)3通过如下反应制得:3CH42(HB=NH)36H2O=3CO26H3BNH3。对合成A反应方程式的讨论中不正确的是()A反应前后碳原子的杂化类型不变B键角的大小关系:CO2CH4H2OC第一电离能大小关系:NOCBHD生成物H3BNH3中存在配位键【解析】由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp。【答案】A5(2012浙江自选模块)下列物质变化,只与范德华力有关的是()A干冰熔化B乙酸汽化C乙醇与丙酮混溶D溶于水【解析】干冰为分子晶体,熔化时只需破坏范德华力;乙酸、乙醇、分子间均存在范德华力和氢键,因此B、C、D三者变化过程中
3、均需克服两种作用力。【答案】A6(2013安徽高考)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:元素相关信息XX的最高价氧化物对应的水化物化学式为H2XO3YY是地壳中含量最高的元素ZZ的基态原子最外层电子排布式为3s23p1WW的一种核素的质量数为28,中子数为14(1)W位于元素周期表第_周期第_族;W的原子半径比X的_(填“大”或“小”)。(2)Z的第一电离能比W的_(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是_;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称_。(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是_;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是_。【解析】先根据题给条件判断元素的种类,再结合具体元素及其化合物的性质进行分析,在解决问题时要注意相关知识的综合应用。(1)根据题给信息,可以初步判断X为第A族元素,当判断出Y为O元素时,即可确定X为C元素;Z的最外层电子数为3,共有三个电子层,所以Z为Al元素;由质子数质量数中
4、子数,可以确定W的质子数为14,所以W为Si元素。由此可以判断W位于元素周期表第三周期第A族;W和X是同一主族元素,且W在X的下一周期,所以W的原子半径大于X的原子半径。(2)Z和W属于同周期元素,同周期元素的第一电离能从左向右呈逐渐增大趋势,所以Z的第一电离能小于W的;XY2为CO2,属于分子晶体,所以由固态变为气态时克服的作用力为分子间作用力;H、C、O三种元素可组成多种能形成同种分子间氢键的化合物,比如乙酸等。(3)Z单质即为铝,铝和盐酸反应生成氯化铝,向氯化铝中滴加氢氧化钠溶液,发生的反应主要分为两个阶段。第一阶段:先生成氢氧化铝沉淀;第二阶段:氢氧化钠过量时,氢氧化铝沉淀溶解。W单质即为硅,硅和氢氟酸反应生成SiF4和H2两种气体。【答案】(1)三A大(2)小分子间作用力乙酸(其他合理答案均可)(3)先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液Si4HF=SiF42H27(2013德阳模拟)有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为ns
《精品高考化学二轮复习收尾练:物质结构与性质含新题详解》由会员m****分享,可在线阅读,更多相关《精品高考化学二轮复习收尾练:物质结构与性质含新题详解》请在金锄头文库上搜索。

车身前处理电泳工艺流程

校内运动会加油稿
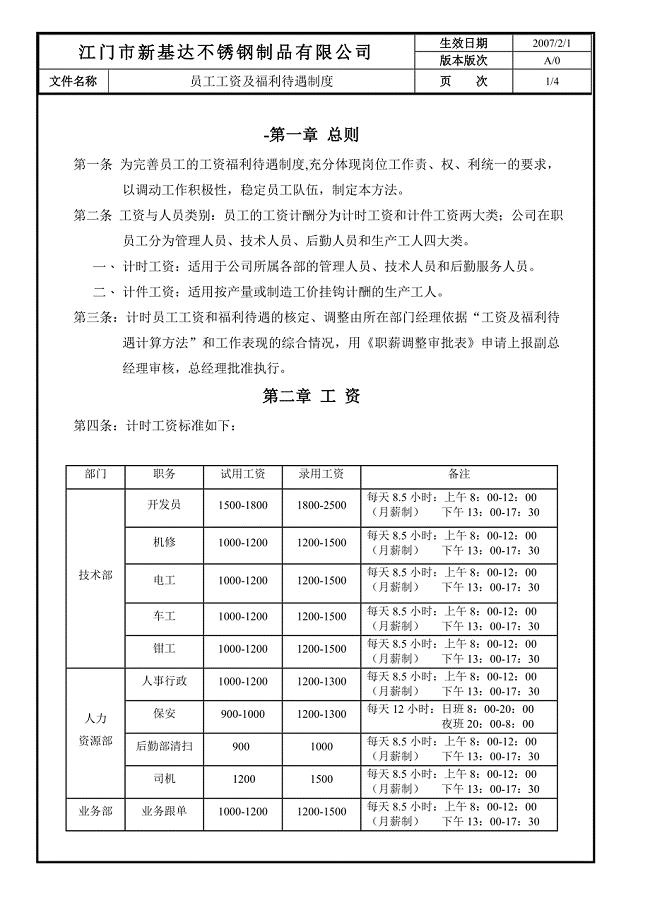
员工工资及福利待遇制度.......doc

2023拓展训练心得体会5篇.docx

2023年中秋节日记61.docx

2023年办公室工作总结学院办公室工作总结2范文.docx

290-庐江三中2012年党风廉政建设工作计划.doc

2023年版高压电工考试内部题库必考点含答案.docx

电梯基础专项工程施工组织设计方案培训资料全

九年级上英语RJ导学案Unit 6 导学案

2021年生产工作计划范文集锦十篇

《青春放歌》聆听教学案例分析.doc

2023年关于基层政策及外来人口管理工作的调研报告.docx

2020年全国I卷高考作文解析

(完整word版)外卖送餐合同.doc

2023小学学年第一学期德育工作参考计划.docx

汽车冲压件生产项目可行性研究报告-申请建议书用可修改样本.doc

生产计划管理制度及考核办法(四篇)

留园建筑设计分析

2023年司法局依法行政工作总结2.docx
 教室消毒注意事项
教室消毒注意事项
2023-03-30 1页
 山东省园林城市标准
山东省园林城市标准
2024-02-04 8页
 现代材料测试技术复习题及答案
现代材料测试技术复习题及答案
2023-12-19 15页
 关于路基及附属工程监理实施细则
关于路基及附属工程监理实施细则
2022-08-14 32页
 对标分析报告
对标分析报告
2023-12-07 20页
 三.冠词(高考总复习)高三笔记整理
三.冠词(高考总复习)高三笔记整理
2023-01-17 14页
 (完整word版)人教版初一上册英语知识点归纳总结,推荐文档
(完整word版)人教版初一上册英语知识点归纳总结,推荐文档
2023-10-08 11页
 人教版 高中数学 选修221.2.2 导数的运算法则及复合函数的导数教案2
人教版 高中数学 选修221.2.2 导数的运算法则及复合函数的导数教案2
2023-11-15 4页
 防护罩工程施工承包合同2
防护罩工程施工承包合同2
2024-01-25 16页
 公司广州大道改造一期洛溪桥广州南站工程第一标段交通疏解工程施工组织设计方案
公司广州大道改造一期洛溪桥广州南站工程第一标段交通疏解工程施工组织设计方案
2022-12-20 13页

