
EMA药品注册技术
30页1、EMA药品注册技术1.1 欧盟概况欧洲联盟(简称欧盟,EU是由欧洲I共同体(EEC发展而来的,是一个集政治实体和经济实体于一身、在世界上具有重要影响的区域一体化组织。截至2014年10月,欧盟共有28个成员国,人口超过5亿,是世界上最大经济实体。2014年19月我国和欧盟贸易额达到4.58千亿美元,累计同比增长10.2%。欧洲理事会(EuropeanCouncil),即首脑会议,是欧盟的最高权利机构,由成员国国家元首或政府首脑及欧盟委员会主席组成,欧洲理事会主席由成员国选举产生,任期为两年半。欧盟理事会(CounciloftheEuropeanUnion)即部长理事会,主席由各成员国的代表轮流担任,任期半年。它是欧盟最高决策机构,分为由各成员国外长组成的总务理事会和由农业、财经、科研、工业等部长组成的专门委员会。欧洲议会(EuropeanParliament),是欧洲联盟的执行监督和咨询机构,在某些领域有立法职能,并有部分预算决定权,并可以三分之二多数弹劾欧盟委员会,迫其集体辞职。全体会议在斯特拉斯堡和布鲁塞尔举行,委员会会议也设在布鲁塞尔举行,会议秘书处设在卢森堡;自1979年起,欧
2、洲议会议员由成员国直接普选产生,任期5年。欧盟委员会(EuropeanCommission),是欧洲联盟的常设机构和执行机构。负责实施欧洲联盟条约和欧盟理事会做出的决定,向理事会和欧洲议会提出报告和立法动议,处理联盟的日常事务,代表欧盟对外联系和进行贸易等方面的谈判等。在欧盟实施共同体外交和安全政策范围内,只有建议权和参与权。根据马斯特里赫特条约,自1995年起,欧盟委员会任期为5年,设主席1人,副主席2人。该委员会由来自不同成员国28名代表组成。欧盟委员会主席人选由欧盟各成员国政府征询欧洲议会意见后共同提名,欧盟委员会其他委员人选由各成员国政府共同协商提议。按此方式提名的欧盟委员会主席和其他委员须一起经欧洲会议表决同意后,由欧盟成员国政府共同任命。1.2 欧盟的医药管理制度及机构1.2.1 欧盟的医药管理法规欧盟药品管理法规大体由三个层面组成:第一层面是指法令和法规,它们由欧洲议会和欧盟理事会颁布实施,少部分由欧盟委员会颁布实施。法令是欧盟用于建立统一药事法规的法律框架,各成员国需要立法将其转化为本国的法规后执行。第二层面是由欧盟委员会依据有关法令和法规而颁布实施的药品注册监督管理程
3、序和GMP旨南。第三个层面是由欧洲药品管理局颁布实施的一些技术性指南和对一些法规条款作出的技术注释。现行欧盟药品管理法规分为10卷:(1)人用药品法令、法规。(2)人用药品注册管理办法-申请人须知。此卷分为三部分,一是上市许可证申请程序,二是注册中请卷宗的格式及内容,三是注册法规的指南文件。(3)人用药品指南书。包含六部分:一是质量部分;二是生物制品部分;三是非临床部分;四是临床有效性和安全性部分;五是综合事务部分;六是植物药指南部分。(4)人用药品及兽药的GMP旨南。包括三个部分和19个附录,这三部分分别为:一是药品GMPS本要求,共9章;二是活性成分作为起始物料的基本要求;三是GMPI关文件。另外GM怀目关的一些其他文件也包含在本卷中,如GM睑查程序及以包含EU格式和程序的信息更新交流,GD阴。(5)兽药法令法规。(6)兽药注册-申请人须知。(7)兽药指南。包含四部分:一是质量部分;二是安全性和残留指南;三是有效性部分;四是免疫性产品指南。(8)最大残留限度。建立以禽畜食品中兽药最大残留限度标准。(9)药品安全的持续监控。(10)临床试验。欧盟的药品管理法规体系比较复杂,新法令的颁
4、布往往不是全文替代旧版本,而是在原有文件上进行修改及补充。1.2.2 欧盟药品监管制度1.2.2.1 药品审评程序药品要在欧盟注册上市,就要经历药品审评程序。药品在欧洲经济区上市可通过两种方式进行,国家授权方式和集中授权方式。集中授权方式即“集中程序”,即药品通过EMEA勺上市许可后,即可在所有欧盟成员国上市,对应的审批程序是针对整个欧盟市场的“集中审批程序。国家授权方式对应的注册程序包括“非集中程序”、各成员国之间的“互认程序”和成员国自主的“成员国审批程序”。1、集中审评程序(CentralisedProcedure,CP)集中审评药品范围:包括所有生物技术及其它高科技工艺制备的人用药品和兽药产品;治疗艾滋病、月中瘤、糖尿病、神经退化(痴呆症)、自身免疫疾病及其他免疫障碍及罕见病的包含新活性成分的人用药物;用于促进动物生长、增加动物收益的药品;根据Regulation(EC)No141/2000定义为孤儿药的药物;不适用于Regulation(EC)No726/2004Article3(3)的基因药物。上述以外的其它创新药物,企业也可向欧洲药品审评管理局递交集中审评中请。符合上述规
《EMA药品注册技术》由会员桔****分享,可在线阅读,更多相关《EMA药品注册技术》请在金锄头文库上搜索。

教学设计试题及答案

六年级人教PEP版英语春季学期连词成句专项积累练习

第二届励志校园感动福建观后感

电气设备常用文字符号-基本文字符

影响3D打印件精度的7大因素

2022年医院目标管理任务完成情况自查自评报告

会计基础知识点总结

2023放射科年度工作总结样本(六篇).doc

妇幼保健2023年度总结(2篇).doc

以房抵债协议(七篇)

不明原因的长时间提心吊胆、肌肉紧张可能是焦虑症!

安全检查验收全套表格40余个

PEC电气工程专业英语证书考试-电气工程专有名词3

二年级品德与社会上册 主题1 坐立走有精神教案 沪科版
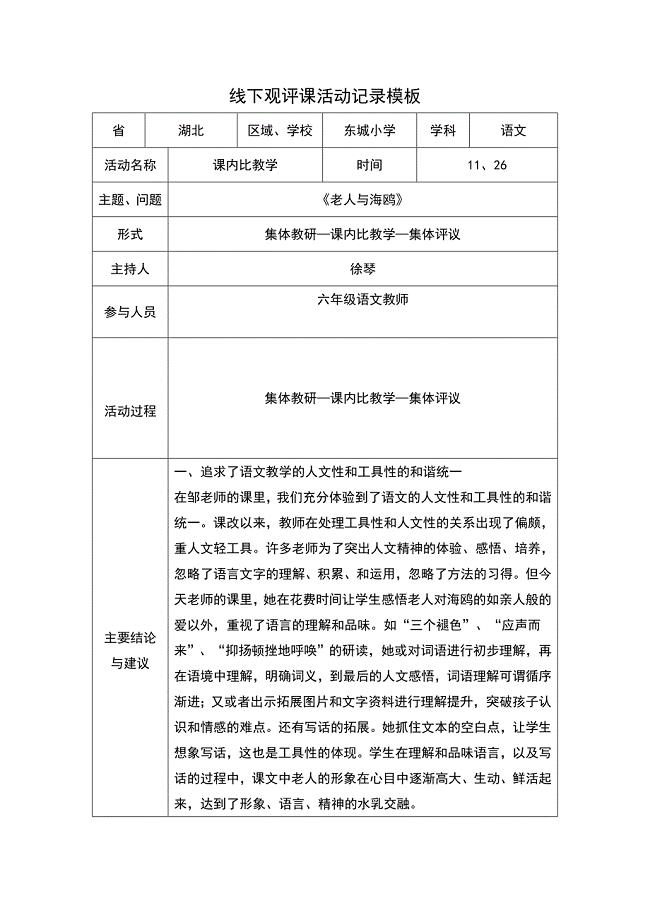
线下活动记录模版 (6)

《从百草园到三味书屋》PPT课件使用说明

工程施工承包合同书范本(六篇)

教研室赴县春季开学检查汇报材料

砖砌体分项工程质量技术交底内容应知应会清单

二○○三年纪检监察工作思路
 车间防静电日常工作点检CHECKLIST
车间防静电日常工作点检CHECKLIST
2023-04-17 1页
 【地理】2013年高考真题——文综地理(天津卷)解析版
【地理】2013年高考真题——文综地理(天津卷)解析版
2023-04-19 8页
 合肥某景观绿化工程施工组织设计方案czsu
合肥某景观绿化工程施工组织设计方案czsu
2022-11-29 50页
 Oracle_DBA面试题
Oracle_DBA面试题
2023-06-15 11页
 北京某公司系统设计说明书
北京某公司系统设计说明书
2023-10-01 120页
 劳动定额考试及答案
劳动定额考试及答案
2023-05-21 23页
 医院职业药师考试题库
医院职业药师考试题库
2022-09-15 11页
 急诊科护士对严重创伤病人护理分析
急诊科护士对严重创伤病人护理分析
2022-09-26 3页
 急诊科常用药
急诊科常用药
2023-05-19 7页
 危化管理制度
危化管理制度
2023-01-06 6页

