
物质的量及其应用
12页1、物质的量及其应用高考导航方向明 名师解读新考纲,探究高考新动向考纲解读1了解物质的量的含义,并能用于进行简单的化学计算。2了解物质的量的单位摩尔(mol)以及摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。3根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。4了解相对原子质量、相对分子质量的定义,并能进行有关计算。5能运用化学方程式和离子方程式进行有关计算。6了解溶液的组成。了解溶液中溶质质量分数的含义,并能用于简单计算。7能根据要求配制一定溶质质量分数和一定物质的量浓度的溶液。热身练习重真题 高考真题有灵性,课前饭后碰一碰真题链接1(2013全国新课标卷9)N0为阿伏加德罗常数的值。下列叙述正确的是()A1.0 L 1.0 molL1的NaAlO2水溶液中含有的氧原子数为2N0B12 g石墨烯(单层石墨)中含有六元环的个数为0.5N0C25时pH13的NaOH溶液中含有OH的数目为0.1N0D1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N0解析:A项,NaAlO2水溶液的H2O中也存在氧原子;B项,一个碳原子被3个
2、六元环共用,故1个六元环实际占有的碳原子数为2,因此12 g(即1 mol)石墨烯中含有六元环的个数为0.5N0;C项,没有说明溶液的体积无法计算;D项,1 mol OH含有的电子数为9N0,1 mol OH含有的电子数为10N0。答案:B2(2013全国大纲8)下列关于同温同压下的两种气体12C18O和14N2的判断正确的是()A体积相等时密度相等B原子数相等时具有的中子数相等C体积相等时具有的电子数相等D质量相等时具有的质子数相等解析:根据阿伏加德罗定律结合微粒间相互关系逐一分析。A.根据阿伏加德罗定律,同温同压下,同体积的任何气体含有相同的分子数,即气体的物质的量相同,但由于12C18O与14N2摩尔质量不相等,故质量不相等,密度也不相等。B.二者都是双原子分子,原子数相等时二者的物质的量相等,二者所含中子数不相等,1个12C18O分子含有16个中子,1个14N2分子含有14个中子。C.同温同压下,同体积的气体的物质的量相等,且1分子12C18O与14N2中均含有14个电子,故12C18O与14N2具有的电子数相等。D.12C18O与14N2质子数相等,质量相等的二者物质的量不相
3、等,含有的质子数也不相等。答案:C名校模拟3(2013北京市海淀区第二学期期末练习11)下列说法不正确的是()A等质量的乙烯和丙烯中含有的共用电子对数目相等B等质量的14NO和13CO气体中含有的中子数相等C10.6 g Na2CO3固体中含阴阳离子总数约为1.8061023D5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等解析:A项,乙烯和丙烯的最简式都是CH2,故等质量的乙烯和丙烯中含有的共用电子对数目相等;B项,14NO和13CO气体的中子数都是15,但是等质量的14NO和13CO气体的物质的量不同;C项,1 mol Na2CO3固体中含有2 mol Na和1 mol CO,故0.1 mol Na2CO3固体中含阴阳离子总数约为1.8061023;D项,铁、铜过量,以0.1 mol氯气为标准计算转移的电子数。答案:B4(2013石家庄市质检(二)10)设NA为阿伏加德罗常数的值,下列说法正确的是()A标准状况下,22.4 L二氯甲烷中含有的分子数目为NAB常温常压下,3.4 g NH3中含有的质子数目为2NAC常温常压下,64 g O2和O3混合气体中
4、含有的原子数目为5NAD1 mol O2与金属钠完全反应生成过氧化钠,转移电子的数目为4NA解析:二氯甲烷在标准状况下是无色液体,22.4 L二氯甲烷的物质的量不是1 mol,A错误;1 mol NH3含有10 mol质子,3.4 g NH3的物质的量为0.2 mol,含有的质子数为2NA,B正确;64 g混合气体中含有的原子数目为4NA,C错误;1 mol O2与金属钠完全反应生成过氧化钠,过氧化钠中氧元素化合价为1,转移电子数目为2NA,D错误。答案:B高频考点大整合核心知识巧记忆,易错常考有妙计考点整合1关于以物质的量为中心的各化学量的相互关系2阿伏加德罗定律及其推论(1)内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。温馨提示:使用范围是气体,可以是单一气体也可以是混合气体;使用条件是同温、同压、同体积(或同物质的量),相同数目的分子(不是相同数目的原子或离子等其他粒子)。(2)阿伏加德罗定律的推论(可通过pVnRT导出)温馨提示:1 mol任何微粒的粒子数为阿伏加德罗常数,其不因温度、压强等条件的改变而改变。应用阿伏加德罗定律及其推论时,首先要判断物质在所
《物质的量及其应用》由会员博****1分享,可在线阅读,更多相关《物质的量及其应用》请在金锄头文库上搜索。

2022年员工个人离职申请书范文4篇(2022年员工个人离职申请书范文怎么写)

e抗拔桩施工方案中间风井(人工挖孔桩) 改

年产5000套大型矿山输送机械项目商业计划书写作模板

各利率汇率利差总结8种

2023年校本培训计划标准模板(三篇).doc

多功能室、电教器材室管理制度
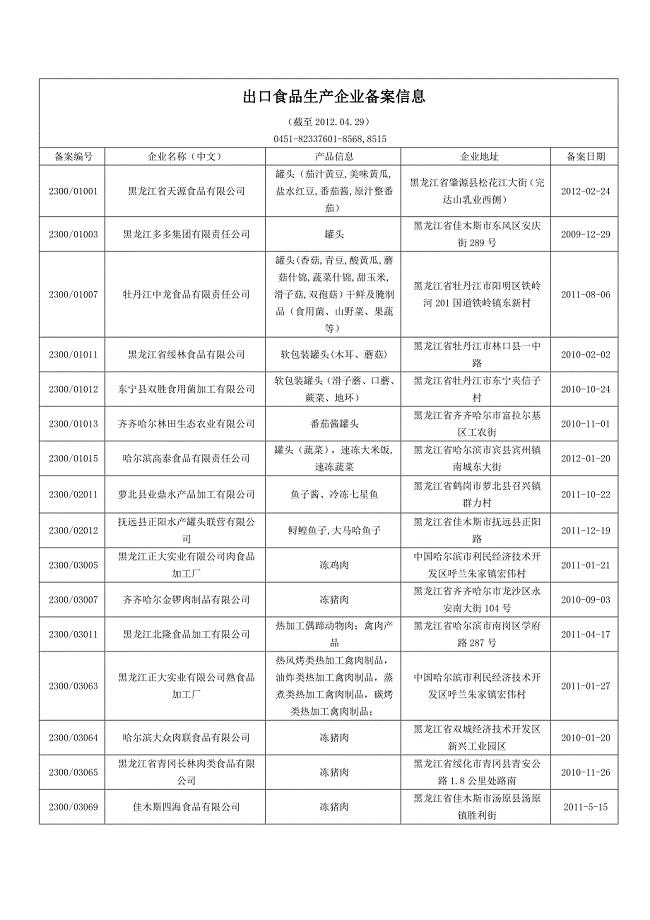
出口食品生产企业备案信息

阅读短文,完成练习

《乡约诗韵罗江》节目文稿

写失业证明格式

大连理工大学21春《机电传动与控制》在线作业二满分答案9

燃气泄漏事故处理程序

中药封包疗法流程图操作评分标准参考模板

婚前房产协议规格式版(八篇).doc

广州住房租赁合同样本(8篇).doc

小学六年级作文写作方法总结字

算法导论习题答案

钢结构试题06A

高校毕业实习报告总结参考范文(二篇).doc

中职生自我鉴定2
 单元工程施工质量报验单
单元工程施工质量报验单
2023-04-17 142页
 中医脉象之动脉的介绍
中医脉象之动脉的介绍
2024-02-14 3页
 物电学院电梯机房钢结构与工程实训中心
物电学院电梯机房钢结构与工程实训中心
2024-02-27 19页
 剧本范文格式
剧本范文格式
2023-11-16 2页
 【施工方案】舞台灯光施工方案
【施工方案】舞台灯光施工方案
2022-12-20 26页
 企业内部控制研究-毕业论文
企业内部控制研究-毕业论文
2023-05-01 28页
 题库 交通安全法规
题库 交通安全法规
2023-05-22 37页
 熟悉城市道路的级别与类别
熟悉城市道路的级别与类别
2022-08-27 15页
 地铁站逆作法施工
地铁站逆作法施工
2023-01-02 16页
 物化实验思考题
物化实验思考题
2023-01-06 7页

