
医疗器械注册技术审查指导原则
26页1、医疗器械注册技术审查指导原则医疗器械注册技术审查指导原则制修订工作管理规范第一章总则第一条为加强医疗器械注册管理和医疗器械注册技术审查指导原则(以下简称指导原则)制修订工作的规范化管理,提高注册审查质量,制定本规范。第二条本规范适用于指导原则制修订工作的申报立项、编制审校、征求意见、审核发布、修订和废止。第三条指导原则由国家药品监督管理局(以下简称国家局)发布,用于规范医疗器械注册技术审查、指导医疗器械注册申请人注册申报。指导原则是指导注册申报及技术审评的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用指导原则。第四条指导原则制修订工作应当遵循科学严谨、公开公正、鼓励创新的原则。第五条国家局负责指导原则制修订的管理工作,原国家食品药品监督管理总局医疗器械技术审评中心(以下简称器审中心)负责指导原则制修订的技术组织工作,省级药品监督管理部门对指导原则制修订工作予以支持并组织实施。第六条鼓励科研院所、医疗机构、行业协会、检测机构、生产企业等单位参与指导原则的制修订工作,充分利
2、用社会资源,发挥社会参与的作用,促进指导原则的应用。第二章申报立项第七条指导原则项目申请单位(以下简称申请单位)应为器审中心、各省级医疗器械审评机构或具备条件的相关单位。申请单位申请制定或修订指导原则,原则上应于每年9月份向器审中心申请,并提交医疗器械注册技术审查指导原则制定项目申请表和/或医疗器械注册技术审查指导原则修订项目申请表。对于工作急需的项目,器审中心可根据需要提出制定或修订计划。第八条申请制定的指导原则应符合以下条件之一:(一)符合国家局指导原则相关规划或要求;(二)具有代表性,能够指导该类产品的技术审查;(三)具有通用性,能够指导注册技术审查工作;(四)体现前瞻性,能够促进创新发展;(五)具有一定的复杂性,需进一步统一审评尺度。第九条申请修订的指导原则应符合以下条件之一:(一)现行法律法规进行了调整,对指导原则的内容有较大影响;(二)随着科技发展,产品的作用机理、结构组成、适用范围等发生了较大变化;(三)对产品安全有效的认知水平发生了变化;(四)其他需对指导原则进行修订的情形。第十条器审中心组织召开指导原则制修订项目立项会,根据监管需要和申请单位的能力条件,对申报项目进行
3、审核。第十一条器审中心将拟立项的指导原则制修订项目计划报国家局审批。对批准立项的,器审中心与申请单位签订项目合同,明确双方的责任和义务。第十二条国家局将批准立项的指导原则制修订计划在其网站上发布。第三章编制审校第十三条申请单位应确定指导原则项目负责人和项目组成员,必要时可邀请相关专家和行业代表参与工作。第十四条申请单位应编制工作计划,包括工作目标、工作方法、预期进度、验收标准等内容。在合同签订后30天内,申请单位将工作计划报送器审中心。申请单位原则上应当在1年内完成。第十五条申请单位应按开题启动、中期汇报、征求意见和审校定稿的程序逐步开展工作,保证指导原则的编制质量。第十六条申请单位应根据编制工作需求对生产企业、医疗机构、省级药品监管部门、省级技术审评机构、不良事件监测机构和医疗器械检验机构等进行调研,收集产品研制、生产、检验、临床评价及使用中存在的主要问题和意见,着重考虑以下几点:(一)符合相关法规、强制性的国家和行业标准;(二)针对涉及的实际问题,提出可行的解决方案;(三) 在目前的科技认识水平和现有产品技术基础上,充分考虑国内产业现状和国际发展方向;(四) 符合医疗器械注册技术审
《医疗器械注册技术审查指导原则》由会员re****.1分享,可在线阅读,更多相关《医疗器械注册技术审查指导原则》请在金锄头文库上搜索。

2023年平面设计师个人总结(篇)

丹香郡结构统一措的施 2

车库租赁协议常官方版(7篇)

2022施工员-土建施工基础知识考试题库套卷4(含答案解析)
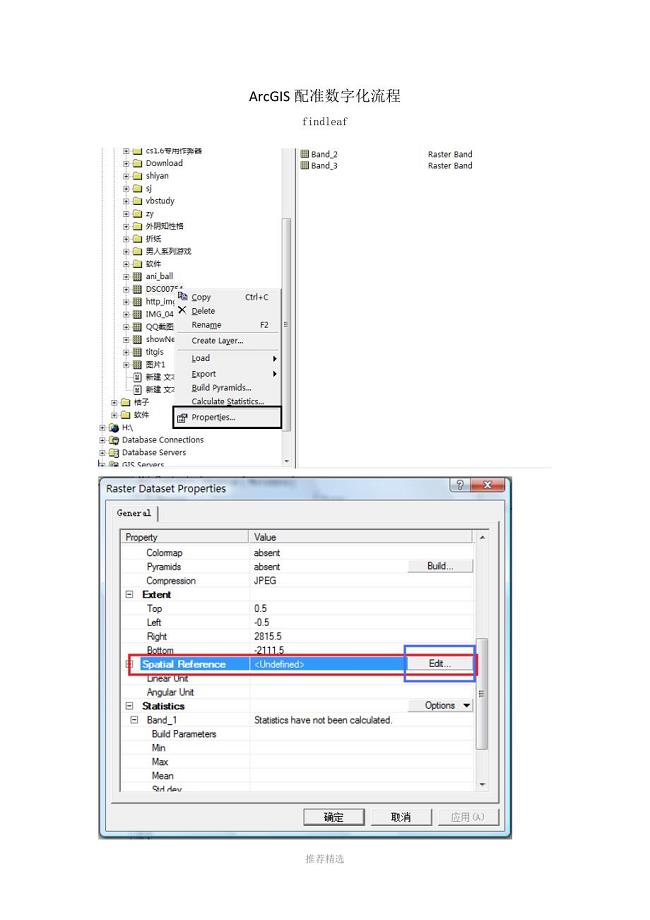
ArcGIS配准数字化流程Word版

个人年终工作总结发言稿通用
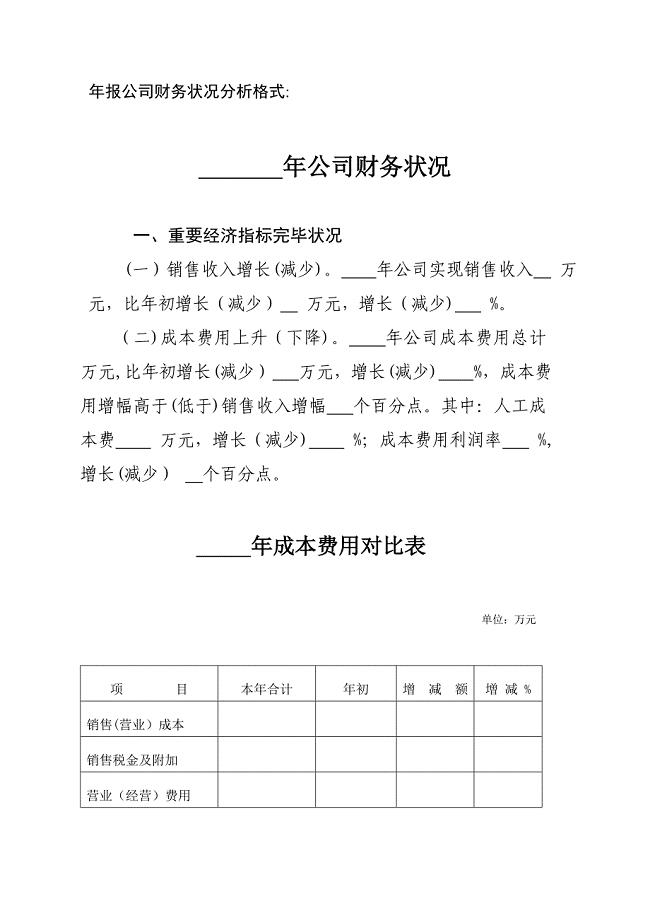
年报企业财务状况分析格式

平车常见问题项目解决方案汇总

离婚房屋分割协议书参考范文(四篇).doc

2023年项目工程施工管理制度6篇

水果片段描写

贯彻落实职代会情况

超市管理工作计划

施工现场物料堆放管理制度.doc

实验五 配送中心分拣系统的仿真

IPQC巡检流程 (DOC 5)

2014-2015学年牛津七年级上学期期末试题(二)

冲压车间生产线物流工位器具的改善设计分析

2023年度骨科护士工作总结

最新 【湘教版】七年级上册数学:第1章 小结与复习
 派遣员工劳务合同模板
派遣员工劳务合同模板
2023-12-04 6页
 项目验收大纲
项目验收大纲
2022-11-19 2页
 合同能源管理模式下风险管理理论的探索
合同能源管理模式下风险管理理论的探索
2023-11-23 2页
 销售部团队组建计划
销售部团队组建计划
2022-11-03 9页
 腹腔引流管的护理
腹腔引流管的护理
2023-12-22 3页
 上市公司人力资源信息化系统需求说明书
上市公司人力资源信息化系统需求说明书
2023-02-08 8页
 北方电信计费系统说明
北方电信计费系统说明
2023-01-24 90页
 讨论《市政府工作报告》座谈会上的讲话
讨论《市政府工作报告》座谈会上的讲话
2023-08-25 8页
 非选择题标准练(二)
非选择题标准练(二)
2023-03-21 5页
 企业商业计划书样本(23页)
企业商业计划书样本(23页)
2023-05-13 37页

