
完整版高考化学总结SCN的性质及有关内容
5页1、总结 S,C,N 的性质及有关内容1. 硫的存在及物理性质1. 存在: 游离态 : 火山口附近和深藏于地下的硫磺矿( 如: 美国的路易斯安那州和得克萨2. 斯州盛产单质硫 )化合态 : 硫化物 辉锑矿 (Sb 2S3) 湖南冷水江 ( 世界锑都之称 )黄铁矿 (FeS2) 黄铜矿 (CuFeS2)硫酸盐 石膏 (CaSO4.2H2O) 重晶石 (BaSO4) 芒硝 (Na2SO4.10H2O) 在煤和石油里都含有一定量的化合态的硫( 蛋白质 )3. 物理性质 :结构 : S 8 分子构成的分子晶体 .溶解性 : 易溶于 CS2, 微溶于酒精 , 难溶于水 ( 从相似相溶的原理去解释 ) 演示 将硫磺在坩埚上加热 , 观察其颜色 , 粘度的变化 . 最后将其倒入冷水 中 , 形成弹性硫 , ( 很慢地转化为斜方硫 ) 同素异型体 : 斜方硫 ( 正交硫 , 菱形硫 ) 和 单斜硫 颜色 : 浅黄色晶体硫华: 硫沸腾产生的蒸汽里有 S8,S 6,S 4,S 2等分子, 温度越高 , S 8越少, S 2越 多 , 硫蒸汽冷却直接成为硫粉 , 不经过液体阶段 , 这种硫粉纯度高 , 叫硫 华
2、.1. 硫的化学性质 : 从硫的原子结构和化合价分析硫的化学性质 (并同氧,氯作对比 )1. 氧化性 :2. 演示 (1) 将硫粉与还原性铁粉混合均匀 , 平铺在石棉网上 , 用烧热的玻璃棒杵 在混合物上 , 观察现象 .(2)在试管中将硫粉加热至棕色蒸汽上升至试管中部 , 在将打磨干净的铜丝插入蒸 汽中 , 观察现象 .Fe + S = FeS2Cu + S = Cu 2S (并同氯气与铜 ,铁反应作对比 : 反应现象 , 产物颜色 , 产物价态 ) 2Al + 3S = Al 2S3Hg + S = HgS(Black) ( 撒落的水银的处理 , 古代的炼丹术 )H2 + S = H 2S(可逆)C + 2S = CS 2(高温)3. 还原性 :S + O2 = SO2S + Cl 2 = SCl 2(加热, 还有 S2Cl2)S + 3F 2 = SF61. 硫的用途 : 硫酸 黑火药 硫磺膏 火柴头 硫化橡胶碳1. 碳的单质(1)碳的单质主要有金刚石、石墨和常见的炭。(2)由于金刚石和石墨里碳原子的排列不同,导致它们的物理性质有较大的差异。( 3)常见的炭包括:木炭、炭黑、活性
3、炭、焦炭。(4)在常温下,单质碳的化学性质不活泼,但随着温度的升高,其化学活动性大大增 强。 可燃性:C O2 点燃 CO2(O2充足)2C O2 点燃 2CO(O2 不充足) 还原性:C co2C 2CuO咼温咼温2CO2CuCO22. 碳的氧化物:(1) CO与CO2的比较:COCO2结构1个分子中有一个氧原子1个分子中有2个氧原子 密度略小于空气大于空气溶解性难溶可溶收集方法只能用排水法只能用瓶口向上排气法:C与O的质 量比3: 43: 8C兀素化合 价+2价+4价可燃性有 2CO O2 点燃 2CO2无还原性有 CO CuO Cu CO2无毒性有,与血红蛋白反应无高温氧化性无有 CO2 C-温 2CO与出0反应不能反应,能 CO2 + H2O=H2CO3与石灰水 反应不能反应冃能 Ca(OH)2 co2CaCO3H20在一定条件下可以相互转化关系CCO2、COCuO 或 O2(2) CO2一般不能燃烧,也不能支持燃烧,密度比空气大,所以可用CO2灭火。(3)CO对空气的污染: 产生CO的两种主要方式:碳燃烧不充分:2C 02点燃2COC02遇炽热的碳:CO2 C 高温 2C0
4、污染源:主要来自含碳燃料的燃烧,石油炼制,钢铁冶炼以及汽车排放的废气等。 实验室对多余的 CO气体(尾气)可用燃烧的方法使之变成 C02,防止对空气的污染。(4) 做CO燃烧和还原性实验前,必须检验 CO的纯度,防止不纯的 CO燃烧时发生 爆炸。3. 碳酸钙:化学性质:(1 )能跟盐酸反应:CaCO3 2HCl CaCl2 CO2H2O此反应用于实验室制备 CO2气体(2)能跟CO2和水反应CaCO3 CO2 H2O Ca(HCO3)2(3)高温分解:咼温CaCO3CaO CO2氮气1. 由于氮分子(J: I )的键能很大,结构稳定,在常温下它很不活泼。 但在高温下, 氮分子也能跟氢气、氧气、金属等许多物质起化学反应。2. 氮有很多氧化物,其中一氧化氮和二氧化氮是两种重要的氮的氧化物。氮是一种重要元素,它以双原子分子存在于大气中,约占大气总体积的 78%和质量的75%。除了大气是氮的贮藏库外,氮也以化合态形式存在于很多无机物(如硝酸钠和硝酸钾)和有机物(如蛋白质和核酸,二者都是形成生命的重要物质)中。工业上所用的氮气,通常是以空气为原料,将空气液化后,利用液态空气中液态氮的沸点比液态氧
《完整版高考化学总结SCN的性质及有关内容》由会员新**分享,可在线阅读,更多相关《完整版高考化学总结SCN的性质及有关内容》请在金锄头文库上搜索。

2023公路所项目部年终工作总结.doc

2023年关于扶贫领域不正之风和腐败问题专项治理工作总结范文.doc

技术开发合同范文(汇编17篇).docx

小学生受资助学生感谢信范文.doc

心理学个人成长报告

班主任月度工作总结(5篇)

爱国电影观后有感8篇范文版本.docx

广东工业设计学院模具考试卷答案.doc

销售动员大会发言稿15篇
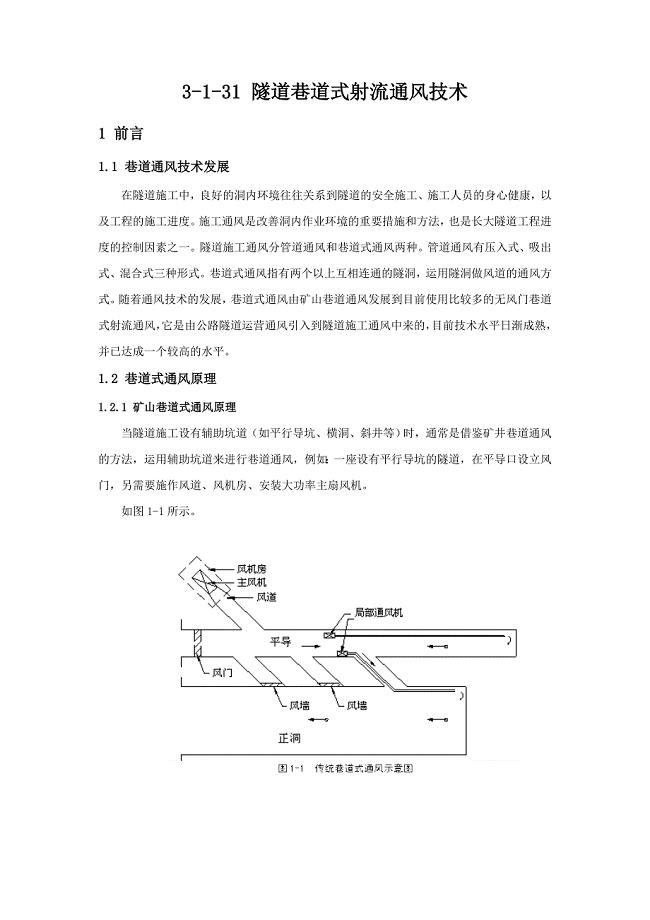
隧道巷道式射流通风技术.doc

《三峡》 教学案.doc

好学生不是管出来的而是惯出来的.doc

职业学校技能大赛现代制造类项目竞赛实施

最新公司发言稿

学生会部门总结范本精选3篇.docx

冬日苹果甜点5款

2023年我校安全工作计划.docx

安盛—湖南亚华宾佳乐乳业公生产管理部考核表

2023春季小学生安全教学工作计划范文(五篇).doc

建筑电气安装施工组织设计方案
 浙摄版小学信息技术五年级下册表格式教案
浙摄版小学信息技术五年级下册表格式教案
2023-05-08 30页
 2019管理会计选择题
2019管理会计选择题
2022-09-20 10页
 煤层气发电项目申请建设可研报告
煤层气发电项目申请建设可研报告
2022-10-17 72页
 小学六年级体育达标标准
小学六年级体育达标标准
2022-11-16 2页
 王静课堂观察记录表单(1)
王静课堂观察记录表单(1)
2024-01-04 5页
 最新《市政工程》陕西某室外管道施工组织设计
最新《市政工程》陕西某室外管道施工组织设计
2022-10-24 37页
 初三综合复习
初三综合复习
2023-11-15 2页
 光的折射第一课时学案
光的折射第一课时学案
2024-01-14 2页
 某酒店结构设计计算书
某酒店结构设计计算书
2023-11-05 39页
 风险分级管控设备设施清单
风险分级管控设备设施清单
2024-02-18 143页

