
鲁科版高中化学选修四:专题讲座(四)化学平衡图象的常见类型及解题方法
6页1、专题讲座(四)化学平衡图象的常见类型及解题方法1常见类型。(1)速率时间图象(vt图象)。既能表示反应速率的变更,又能表示平衡移动的速率时间图象,如图所示图象分析。图A:a.t0时,反应由正反应起先;btt1时,在变更条件的瞬间,v(正)变大,v(逆)不变;ctt1时,v(正)v(逆),平衡向正反应方向移动,随后又达到新的平衡状态。变更的条件是增大反应物的浓度。图B:a.t0时,反应由正反应起先;btt1时,v(正)、v(逆)在变更条件时同时增大;ctt1时,v(逆)v(正),平衡向逆反应方向移动,随后又达到新的平衡状态。变更的条件可能是上升温度或增大压强。图C:a.t0时,反应由正反应起先;btt1时,v(正)、v(逆)在变更条件时同倍增大;ctt1时,v(正)v(逆),平衡不移动。变更的条件可能是运用了催化剂或增大压强(反应为气态物质系数不变的反应)。规律总结。a在分析vt图象时,要特殊留意两个方面:一是反应速率的变更即v(正)、v(逆)是都增大或都减小条件变更的瞬间,v(正)、v(逆)的起点与原平衡点不重合,还是一个增大(或减小)而另一个不变条件变更的瞬间,v(正)、v(逆)中不
2、变的那一个起点与原平衡点重合;二是平衡移动的方向,速率大的速率曲线在上面,且向该方向移动。b画出vt图象的“三步曲”:第一步,画出原平衡建立的过程;其次步,依据条件变更时的速率变更,确定两个起点都在原平衡点的上(下),或一个在上(下)另一个不变;第三步,依据平衡移动方向确定两条曲线,完成图象。(2)浓度时间图象(ct图象)。此类图象能说明各平衡体系组分(或某一成分)的物质的量浓度在反应过程中的变更状况。此类图象中各物质曲线转折点(达平衡)的时刻相同,各物质浓度变更的内在联系及比例符合化学方程式中的系数关系,如图所示。甲乙(3)速率温度(压强)图象(vT或vp图象)。反映正、逆反应速率(或放热、吸热反应的速率)随温度或压强的变更曲线,用于推断反应的H或反应前后气态物质系数关系,如图所示。甲乙(4)恒压(温)线。该类图象的纵坐标为物质的平衡浓度(c)或反应物的转化率(),横坐标为温度(T)或压强(p),常见类型如图所示两种状况。甲乙(5)含量时间温度(压强)图象。此类图象表示的是不同温度(或压强)下反应物(或生成物)的物质的量分数(或体积分数或转化率)的变更过程,包含达到平衡所需的时间和不
《鲁科版高中化学选修四:专题讲座(四)化学平衡图象的常见类型及解题方法》由会员M****1分享,可在线阅读,更多相关《鲁科版高中化学选修四:专题讲座(四)化学平衡图象的常见类型及解题方法》请在金锄头文库上搜索。

中医儿科学考试题库及答案

2023年母爱演讲稿300精选7篇

学校三八红旗手事迹

人才发展规划范文

小学心理健康教育讲座稿

八年级物理(上)期末试题

机关单位婚假请假条范文

半脱产学生辅导员申请表
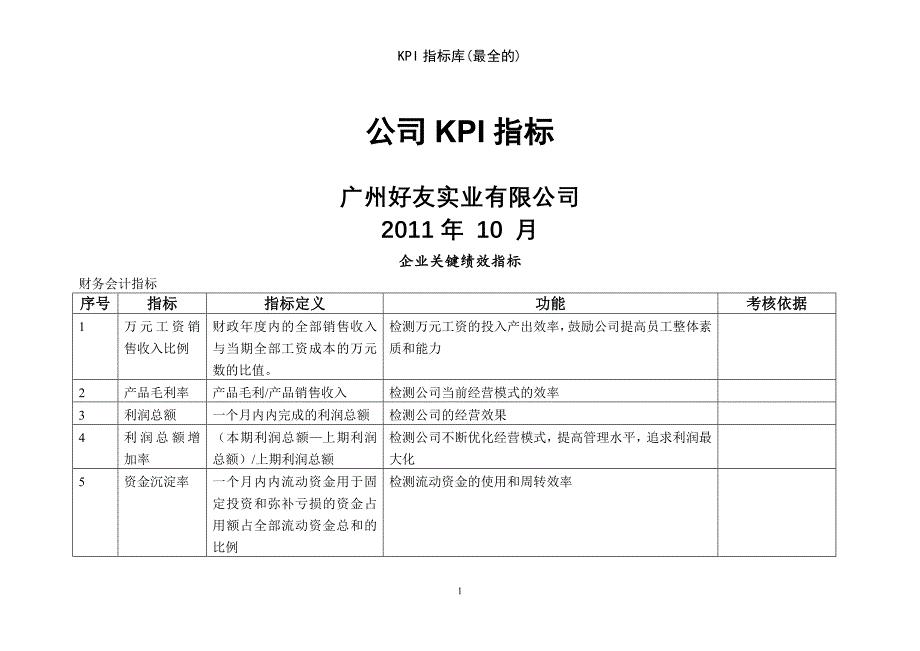
KPI指标库最全的

个人职业生涯规划设计书工程造价

焊接质量管理办法

重庆万州区购房协议范文(七篇).doc

湖南省泸溪县白沙中学2016届九年级数学第一次月考试题新人教版

2022小学工会活动工作计划

珍爱生命安全第一演讲稿

AnswerKey.docx

以深入学习实践科学发展观为契机 加快我村新农村建设的步伐

制定事故应急救援预案的目范文(5篇).doc
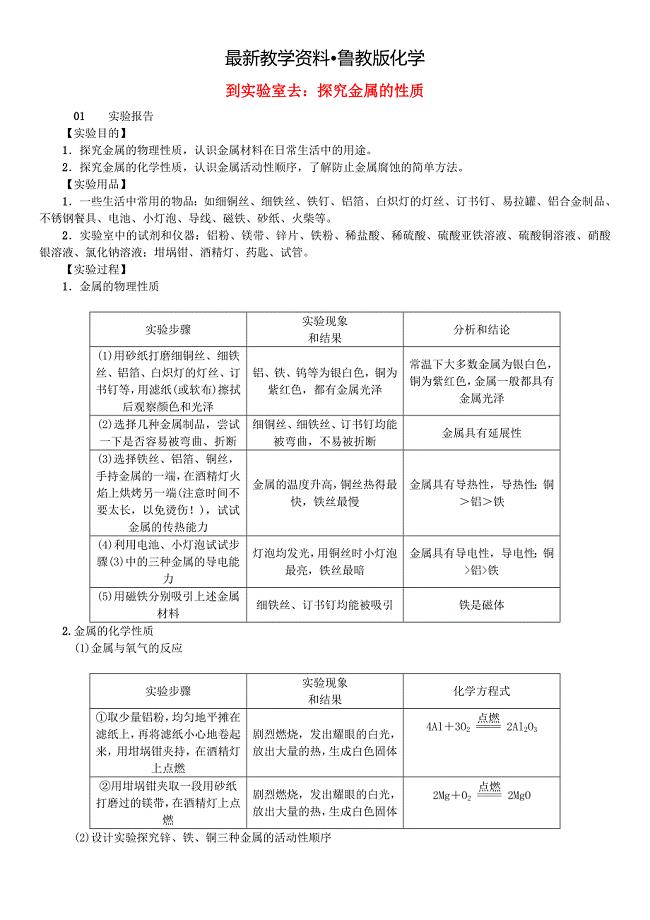
【最新资料】九年级化学下册第九单元金属到实验室去探究金属的性质同步测试鲁教版

修理厂与财产保险合作管理办法
 幼儿园元旦节活动计划标准范文(4篇)
幼儿园元旦节活动计划标准范文(4篇)
2022-11-03 9页
 2022大学生毕业典礼心得体会
2022大学生毕业典礼心得体会
2023-08-18 2页
 农村小学综合实践活动推广阶段工作计划(四篇)
农村小学综合实践活动推广阶段工作计划(四篇)
2023-08-09 11页
 小班第二学期幼儿园班级工作计划范本(2篇).doc
小班第二学期幼儿园班级工作计划范本(2篇).doc
2023-11-24 3页
 新编七年级地理上册第一章第一节地球和地球仪第3课时学案新版新人教版
新编七年级地理上册第一章第一节地球和地球仪第3课时学案新版新人教版
2023-06-30 4页
 社会统计学公式汇总及要点
社会统计学公式汇总及要点
2023-11-25 4页
 【精校版】人教版八年级英语上册Unit 6 Period 3导学案
【精校版】人教版八年级英语上册Unit 6 Period 3导学案
2023-07-08 2页
 2022年财务工作总结
2022年财务工作总结
2022-11-07 6页
 2023年系舞蹈队的工作计划7篇
2023年系舞蹈队的工作计划7篇
2022-08-26 23页
 小班社会魔语教案反思
小班社会魔语教案反思
2023-07-26 6页

