
恒温恒容的等效平衡
11页1、恒温恒容、恒温恒压条件下的化学平衡教学案广州市第四十七中学 毛艳滨考纲要求1 了解化学反应的可逆性。 2了解化学平衡建立的过程。理解化学平衡常数的含义,能够利用化学平衡常数进行简 单的计算。2理解外界条件(浓度,温度,压强,催化剂等)对反应速率和化学平衡的影响,认识 其一般规律。一课前思考:1-1、在恒温时,一固定容积的密闭容器内发生如下反应:2NO2 (气)=N2O4 (气) 达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比, no2的浓度:A 不变 B 增大 C 减小 D 无法判断1-2、在恒温时,一固定容积的密闭容器内发生如下反应:2NO2 (气)=N2O4 (气) 达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比, NO2的体积分数:A 不变 B 增大 C 减小 D 无法判断1-3、在恒温时,一容积可变的密闭容器内发生如下反应:2NO2 (气)=N2O4 (气) 达到平衡时,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比, NO2 的质量百分含量:A 不变B 增大C 减小D 无法判断1-4、一
2、定条件下:2SO2 (g)+ O2 (g)2SO3 (g),AH= akJ/mol(1)若在甲、乙两个容积相等的容器中,分别充入甲: 2molSO2、 1molO2;乙: 1molSO2、 0.5molO2;在上述条件下充分反应,并保持容积不变,当达到平衡后,试比较: 甲、乙两个容器中放出的热量与a的关系; 甲、乙两个容器中 SO2 的转化率的大小关系; 甲、乙两个容器中平衡常数的大小关系;(2) 若在甲、乙两个容积相等的容积中,分别充入:甲:2molSO2、lmolO2;乙:lmolSO2、0.5molO2;在上述条件下充分反应,并保持压强不变,当达到平衡后,试比较 甲、乙两个容器中放出的热量与 a 的关系; 甲、乙两个容器中SO2的转化率的大小关系; 甲、乙两个容器中平衡常数的大小关系; 二、思考与归纳:(1)可逆反应的本质特征是什么?2)什么是转化率?平衡正向移动则转化率一定升高吗?(3) 平衡常数的含义是什么?影响平衡常数的因素有哪些?平衡移动则平衡常数一定会 改变吗?4)上述哪些情况是等效平衡?等效平衡的特征是什么?等效平衡有几种类型?三应用提升:2-1、某温度下,在一容积可
3、变的密闭容器中,反应2A()+B() =2C()达到平衡时,A、(g)(g)(g)B和C的物质的量分别为4moL、2moL和4moL。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:A 均减半B 均加倍C 均增加 1moLD 均减少 1moL 2-2、某温度下,在一容积固定的密闭容器中,反应2A()+B() =2C()达到平衡时,A、(g)(g)(g)B和C的物质的量分别为4moL、2moL和4moL。在相同的温度下,对平衡混合物中三 者的物质的量做如下调整,可使平衡右移的是:A 均减半B 均加倍C 均增加 1moLD 均减少 1moL四实战演练:3-1、.(2007四川高考)向某密闭容器中充入ImolCO和2molH2O(g),发生反应:CO+H2O(g)co2 +h2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时 CO 的体积分数大于 x 的是A0.5molCO+2molH2O(g)+1molCO2+1molH2 B1molCO+1molH2O(g)+1molCO2+1molH2 .C
4、0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2D0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH23-2、(2007江苏高考)一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);AHv0。现将 1mol A 和 2molB 加入甲容器中,将 4 molC 和 2 mol D 加入乙容器中,此时控制活塞 P, 使乙的容积为甲的 2 倍, t1 时两容器内均达到平衡状态(如图 1 所示,隔板 K 不能移动)。 下列说法正确的是A. 保持温度和活塞位置不变,在甲中再加入ImolA和2molB,达到新的平衡后,甲中 C 的浓度是乙中 C 的浓度的 2 倍B. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大C. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的 体积分数是甲中 C 的体积分数的 2 倍D. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙 中反应速iE1时曲率变化情况分别如图2和图3所示前的反应速率变化已省略)五课后反馈:4-1、一定温
《恒温恒容的等效平衡》由会员m****分享,可在线阅读,更多相关《恒温恒容的等效平衡》请在金锄头文库上搜索。
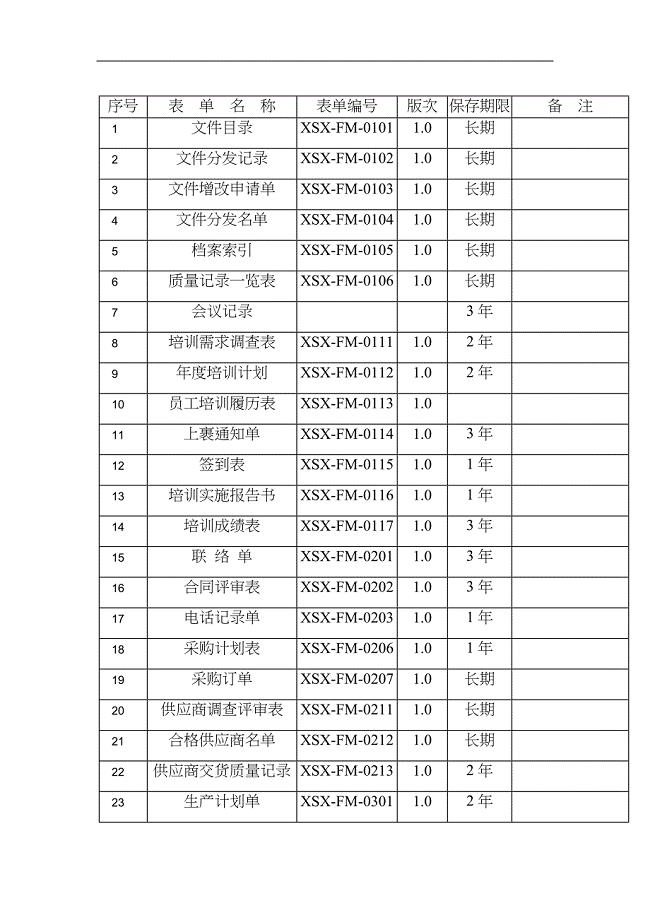
质量记录一览表

堡垒机解决方案

2022年事业单位财务年中个人总结

双十一汽车销售活动策划

2023年在电网公司安全电视电话会议上的致辞.docx

年龄特点是依据

2023年六年级上册英语教案unitways to go to school part B人教PEP.doc

社管办党组成员、副主任届中考核考察述职述廉报告.docx

中学数学教学中“数形结合”思想的运用及实施.doc

钢砼排水管项目创业计划书写作模板

门诊管理办法

2023年赴北师大学习心得体会2.docx

语文二年级下部编版第三单元第3课

劳动关系的调整

高考语文模拟试题图文转换分类汇编(含答案)50.doc

SymantecBackupExec备份还原VMwareESXi虚拟机

2023年在全县防汛抗旱工作会议上的讲话稿范本.docx

建筑机械设备租赁合同格式版(8篇).doc

2023年荥阳法院赴大别山干部学院培训学习2.docx

内科医生工作总结多篇
 金属的重要反应规律及其应用
金属的重要反应规律及其应用
2023-07-15 13页
 桃树在园林景观中的管护技术及应用
桃树在园林景观中的管护技术及应用
2023-10-06 4页
 断路器的四种接线方式
断路器的四种接线方式
2023-08-06 2页
 离婚协议书_1
离婚协议书_1
2023-08-10 2页
 读书心得体会
读书心得体会
2022-12-29 27页
 螺母设计指南
螺母设计指南
2023-03-03 17页
 控制工程课程设计
控制工程课程设计
2023-01-01 18页
 物质分离提纯方法总结
物质分离提纯方法总结
2024-01-13 3页
 美术思政课设计——喜庆吉祥的民间艺术
美术思政课设计——喜庆吉祥的民间艺术
2023-03-04 11页
 GPS同步基准源
GPS同步基准源
2023-12-28 6页

