
高一化学下学期知识点
43页1、一、氧化还原反应1、怎样判断氧化还原反应表象:化合价升降 实质:电子转移注意:凡有单质参加或生成的反应必定是氧化还原反应2、有关概念被氧化(氧化反应) 氧化剂(具有氧化性) 氧化产物(表现氧化性)被还原(还原反应) 还原剂(具有还原性) 还原产物(表现还原性)注意:(1)在同一反应中,氧化反应和还原反应是同时发生(2)用顺口溜记“升失氧,降得还,若说剂正相反”,被氧化对应是氧化产物,被还原对应是还原产物。3、分析氧化还原反应的方法单线桥:双线桥:注意:(1)常见元素的化合价一定要记住,如果对分析化合升降不熟练可以用坐标法来分析。(2)在同一氧化还原反应中,氧化剂得电子总数=还原剂失电子总数。4、氧化性和还原性的判断氧化剂(具有氧化性):凡处于最高价的元素只具有氧化性。最高价的元素(KMnO4、HNO3等)绝大多数的非金属单质(Cl2 、O2等)还原剂(具有还原性):凡处于最低价的元素只具有还原性。最低价的元素(H2S、I等)金属单质既有氧化性,又有还原性的物质:处于中间价态的元素注意:(1)一般的氧化还原反应可以表示为:氧化剂+还原剂=氧化产物+还原产物 氧化剂的氧化性强过氧化产物,还
2、原剂的还原性强过还原产物。(2)当一种物质中有多种元素显氧化性或还原性时,要记住强者显性(锌与硝酸反应为什么不能产生氢气呢?)(3)要记住强弱互变(即原子得电子越容易,其对应阴离子失电子越难,反之也一样)记住:(1)金属活动顺序表(2)同周期、同主族元素性质的递变规律(3)非金属活动顺序元素:FOClBrNISPCSiH单质:F2Cl2O2Br2I2SN2PCSiH2(4)氧化性与还原性的关系F2KmnO4(H+)Cl2浓HNO3稀HNO3浓H2SO4Br2Fe3+Cu2+I2H+Fe2+F Mn2+ ClNO2 NO SO2 BrFe2+Cu IH2Fe5、氧化还原反应方程式配平原理:在同一反应中,氧化剂得电子总数=还原剂失电子总数步骤:列变化、找倍数、配系数注意:在反应式中如果某元素有多个原子变价,可以先配平有变价元素原子数,计算化合价升降按一个整体来计算。类型:一般填系数和缺项填空(一般缺水、酸、碱)二、离子反应、离子方程式1、离子反应的判断凡是在水溶液中进行的反应,就是离子反应2、离子方程式的书写步骤:“写、拆、删、查”注意:(1)哪些物质要拆成离子形式,哪些要保留化学式。大家
3、记住“强酸、强碱、可溶性盐”这三类物质要拆为离子方式,其余要保留分子式。注意浓硫酸、微溶物质的特殊处理方法。(2)检查离子方程式正误的方法,三查(电荷守恒、质量守恒、是否符合反应事实)3、离子共存凡出现下列情况之一的都不能共存(1)生成难溶物常见的有AgBr , AgCl , AgI , CaCO3 , BaCO3 , CaSO3 , BaSO3等(2)生成易挥发性物质常见的有NH3 、CO2 、SO2 、HCl等(3)生成难电离物质常见的有水、氨水、弱酸、弱碱等(4)发生氧化还原反应Fe3+与S2- 、ClO与S2-等三、原子结构1、关系式核电荷数=质子数=核外电子数=原子序数(Z)质量数(A)=质子数(Z)+ 中子数(N)注意:化学反应只是最外层电子数目发生变化,所以阴离子核外电子数=质子数+ |化合价|阳离子核外电子数=质子数- |化合价|2、 所代表的意义3、同位素将原子里具有相同的质子数和不同的中子数的同一元素的原子互称同位素。注意:(1)同位素是指原子,不是单质或化合物(2)一定是指同一种元素(3)化学性质几乎完全相同4、原子核外电子的排布(1)运动的特征:(2)描述电子运
4、动的方法:(3)原子核外电子的排布:符号 K L M N O P Q层序 1 2 3 4 5 6 7(4)熟练掌握原子结构示意图的写法核外电子排布要遵守的四条规则四、元素周期律和元素周期表1、什么是元素周期律?什么是原子序数?什么是元素周期律?元素周期律的实质?元素周期律是谁发现的?2、周期表的结构(1) 周期序数=电子层数 主族序数=最外层电子数=最高正价(2) 记住“七横行七周期,三长三短一不全”,“十八纵行十六族,主副各七族还有零和八”。(3) 周期序数: 一 二 三 四 五 六元素的种数:2 8 8 18 18 32(4)各族的排列顺序(从左到右排)A、A、B、B、B、B、B、B、B、A、A、A、A、A、O注意:A和A同周期元素不一定定相邻3、元素性质的判断依据跟水或酸反应的难易金属性氢氧化物的碱性强弱跟氢气反应的难易非金属性 氢化物的热稳定性最高价含氧酸的酸性强弱注意:上述依据反过也成立。4、元素性质递变规律(1)同周期、同主族元素性质的变化规律注意:金属性(即失电子的性质,具有还原性),非金属性(即得电子的性质,具有氧化性)(2)原子半径大小的判断:先分析电子层数,再分析原
《高一化学下学期知识点》由会员hs****ma分享,可在线阅读,更多相关《高一化学下学期知识点》请在金锄头文库上搜索。

2023年保安表扬信模板10篇.docx

十项卫生保健制度

2023年我爱故乡的杨梅 教案教学设计.doc

2023年《安全管理制度》之道路货物运输安全生产管理制度.docx

2023年聘请合同范本.docx

2022年苏教版五年级数学上册全单元测试题及答案【完整版】.docx

环保公益类海报设计

2023年竞选宣传委员发言稿1范文.docx

图像去噪模型中的差分格式研究-大学毕业设计

2019-2020学年小学数学人教版四年级下册-第六单元小数加法和减法单元卷(2)B卷.docx

2023年保险公司年度个人工作总结(3篇).doc

行政后勤个人工作计划格式范文(三篇).doc

2023年跟老婆认错的检讨书范文.docx

江苏省高邮市车逻初级中学八年级物理下册第六章物体的物理属性导学案无答案人教新课标版

2022年江苏省安全员B证考试历年真题汇总含答案参考49

2023年《说不尽的桥》教学设计.docx

2023年大学生消防安全知识竞赛试题及参考答案
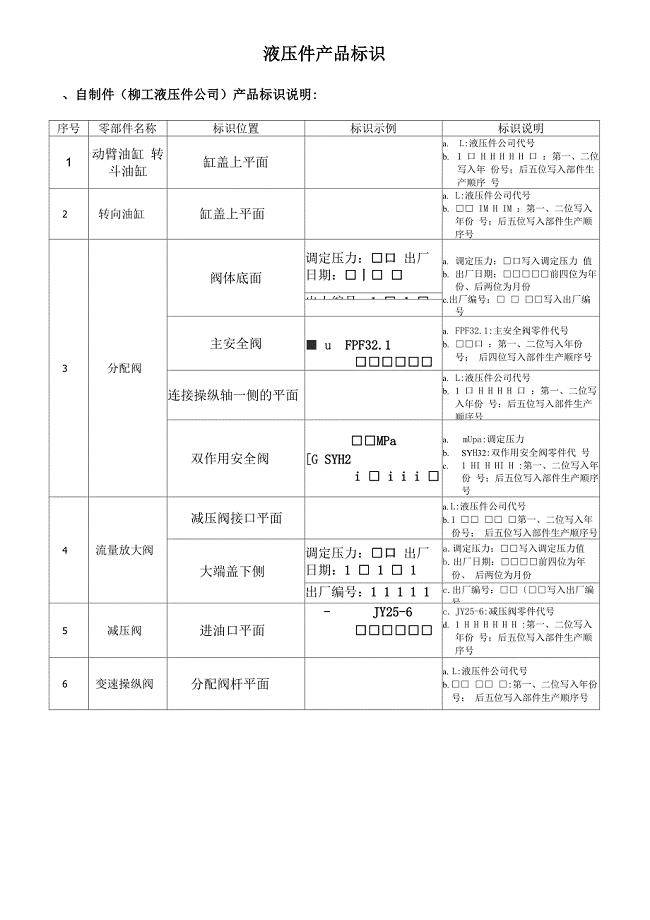
液压件标识
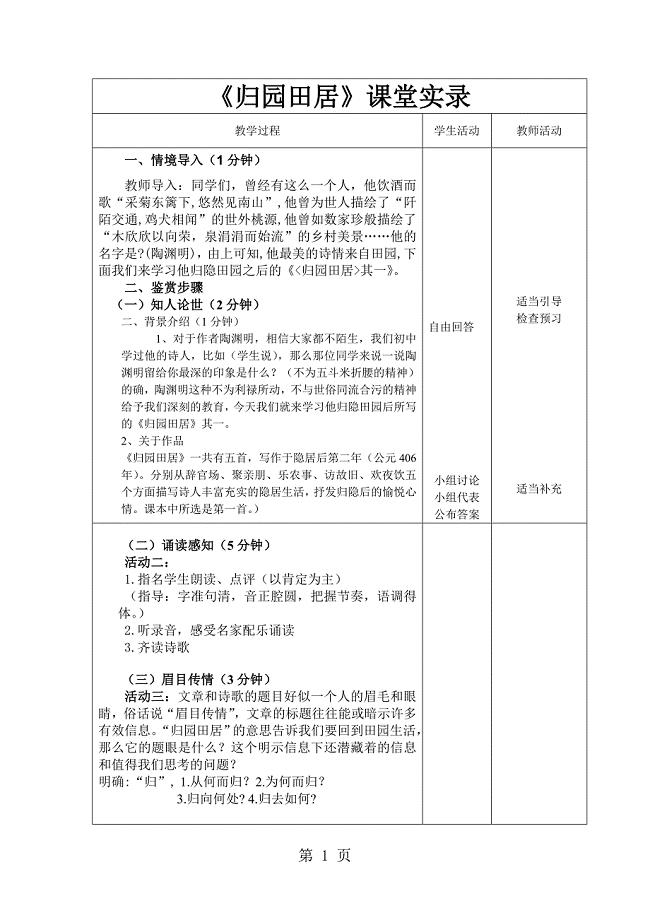
2023年粤教版高中语文必修一第四单元第课《汉魏晋诗三首归园田居》课堂实录.doc

2023年委托书合同模板汇编五篇.docx
 2022年高中语文 项链(莫泊桑)教案
2022年高中语文 项链(莫泊桑)教案
2022-11-06 2页
 2022-2023学年高二英语上学期第一学段考试试题 (II)
2022-2023学年高二英语上学期第一学段考试试题 (II)
2023-12-26 10页
 高中数学必修五综合测试题含答案
高中数学必修五综合测试题含答案
2023-11-09 6页
 2023届海南省部分地区高三5月语文试卷汇编:默写专题(含答案)
2023届海南省部分地区高三5月语文试卷汇编:默写专题(含答案)
2023-09-02 6页
 2022年高二上学期第二次月考生物试卷 含解析
2022年高二上学期第二次月考生物试卷 含解析
2023-08-17 29页
 高一实验班第一次小测验英语试题
高一实验班第一次小测验英语试题
2023-07-21 5页
 2022年高三周练 英语(9.22) 含答案
2022年高三周练 英语(9.22) 含答案
2023-01-19 12页
 常熟高三语文暑假自主学习讲义3答案
常熟高三语文暑假自主学习讲义3答案
2023-11-13 23页
 2014届高考生物一轮复习 第十节 细胞分化 新人教版必修1
2014届高考生物一轮复习 第十节 细胞分化 新人教版必修1
2023-11-25 1页
 高一地理地球的运动单元测试
高一地理地球的运动单元测试
2022-10-30 6页

