
动生化名词解释
42页1、动生化名词解释1 .氨基酸的等电点:当溶液在某一特定的 pH 值时,氨基酸以两性离子的形式存在,正电荷数与负电荷数相等, 净电荷为零, 在直流电场中既不向正极移动也不向负极移动, 这时溶液的 pH 值称为该氨基酸的等电点,用 pI 表示。2 .肽键:是指键,是一个氨基酸的a -COOH基和另一个氨基酸的a - NH2基所形成的酰胺键。3 . 多肽链:由许多氨基酸残基通过肽键彼此连接而成的链状多肽,称为多肽链。 4. 肽平面:肽链主链的肽键具有双键的性质,因而不能自由旋转,使连接在肽键上的六个原子共处于一个平面上,此平面称为肽平面。5. 蛋白质的一级结构:多肽链上各种氨基酸残基的排列顺序,即氨基酸序列。6. 肽单位:多肽链上的重复结构,如 Ca -CO-NH-Ca称为肽单位,每一个肽单位实际 上就是一个肽平面。7. 多肽:含有三个以上的氨基酸的肽统称为多肽。8. 氨基酸残基:多肽链上的每个氨基酸,由于形成肽键而失去了一分子水,成为不完整的 分子形式,这种不完整的氨基酸被称为氨基酸残基。9. 蛋白质二级结构:多肽链主链骨架中,某些肽段可以借助氢键形成有规律的构象,如a-螺旋、3 -折叠和3
2、 -转角;另一些肽段则形成不规则的构象,如无规卷曲。这些多肽链主链骨架中局部的构象,就是二级结构。10. 超二级结构:在球状蛋白质分子的一级结构顺序上,相邻的二级结构常常在三维折叠中相互靠近, 彼此作用, 从而形成有规则的二级结构的聚合体, 就是超 二级结构。 11. 结构域:在较大的蛋白质分子里,多肽链的三维折叠常常形成两个或多个松散连接的近似球状的三维实体,即是结构域。它是球蛋白分子三级结构的折叠单位。 12. 蛋白质三级结构:指一条多肽链在二级结构(超二级结构及结构域)的基础上,进一步的盘绕、 折叠, 从而产生特定的空间结构。 或者说三级结构是指多肽链中所有原子的空间排布。维系三级结构的力有疏水作用力、氢键、范德华力、盐键(静电引力) 。另外二硫键在某些蛋白质中也起着非常重要的作用。13. 蛋白质四级结构:由相同或不同的亚基(或分子)按照一定的排布方式聚合而成的聚合体结构。它包括亚基(或分子)的种类、数目、空间排布以及相互作用。 14. 二硫键:指两个硫原子之间的共价键,在蛋白质分子中二硫键对稳定蛋白质分子构象起重要作用。15. 二面角:在多肽链中,C a碳原子刚好位于互相连接的
3、两个肽平面的交线上。C a碳原子上的C a - N和C a - C都是单键,可以绕键轴旋转,其中以 C a - N旋转的角度称为 , 而以Ca - C旋转的角度称为 W,这就是a -碳原子上的一对二面角。它决定了由a -碳原子连接的两个肽单位的相对位置。16. a -螺旋:是蛋白质多肽链主链二级结构的主要类型之一。肽链主链骨架围绕中心轴盘 绕成螺旋状,称为a -螺旋。17. 3 -折叠或3 -折叠片:二条3 -折叠股平行排布,彼此以氢键相连,可以构成3 -折叠片。3 -折叠片又称为3 -折叠。18. 3 -转角:又称为3 -回折。多肽链中的一段主链骨架以1800返回折叠;由四个连续的氨基酸残基组成;第一个肽单位上的C=O基氧原子和第三个肽单位的N - H基氢原子生成一个氢键。19. 无规卷曲:主链骨架片段中,大多数的二面角(,W)都不相同,其构象不规则。它存在于各种球蛋白之中,含量较多。20. 亚基:较大的球蛋白分子,往往由二条或更多条的多肽链组成功能单位。这些多肽链本身都具有球状的三级结构, 彼此以非共价键相连。 这些多肽链就是球蛋白分子的亚基。 它是 由一条肽链组成,也可以通过二硫
4、键把几条肽链连接在一起组成。 21. 寡聚蛋白:由两个或两个以上的亚基或单体组成的蛋白质统称为寡聚蛋白。22. 蛋白质的高级结构:指一条或数条多肽上的所有原子在三维空间中的排布,又称构象、三维结构、空间结构、立体结构。23. 蛋白质激活:指蛋白质前体在机体需要时经某些蛋白酶的限制性水解,切去部分肽段后变成有活性的蛋白质的过程。24. 分子病:由于基因突变导致蛋白质一级结构突变,使蛋白质生物功能下降或丧失,而产生的疾病被称为分子病。25. 变构效应:也称别构效应,在寡聚蛋白分子中一个亚基由于与配体的结合而发生的构象变化,引起相邻其它亚基的构象和与配体结合的能力亦发生改变的现象。 26. 蛋白质变性:天然蛋白质,在变性因素作用下,其一级结构保持不变,但其高级结构发生了异常的变化,即由天然态(折叠态)变成了变性态(伸展态) ,从而引起了生物功能的丧失,以及物理、化学性质的改变。这种现象被称为蛋 白质的变性。27. 蛋白质复性:除去变性剂后,在适宜的条件下,变性蛋白质从伸展态恢复到折叠态,并恢复全部生物活性的现象叫蛋白质的复性。 28. 蛋白质的等电点:当溶液在某个pH 时,使蛋白质分子所带的
《动生化名词解释》由会员pu****.1分享,可在线阅读,更多相关《动生化名词解释》请在金锄头文库上搜索。

计算机组成原理课程设计论文0

毕业生如何不写进入误区的求职信.doc

留泗路道路施工监理细则OK

2023年九年级班主任工作计划模板(4篇)

大明宫商业城项目可行性研究报告

承办商务会议合同

2023年《荷叶圆圆》教学设计(精选5篇).docx

浙江省温州市第二外国语学校2014-2015学年高一下学期期末考试化学试卷(Word版含解析).doc

园林景观工程施工表格个

2023年高中数学专题题型及解题技巧

油库施工安全协议范本(五篇).doc

临时用电施工电缆线路一般要求.doc

2019年八年级班主任德育个人小结.doc

最新八年级语文下册 课内外文言文趣读精细精炼 专题09 指喻课外篇

建筑施工安全生产操作协议格式版(九篇).doc

夏天来了作文合集15篇

中小学教师心得体会3篇

管理学案例SWOT分析
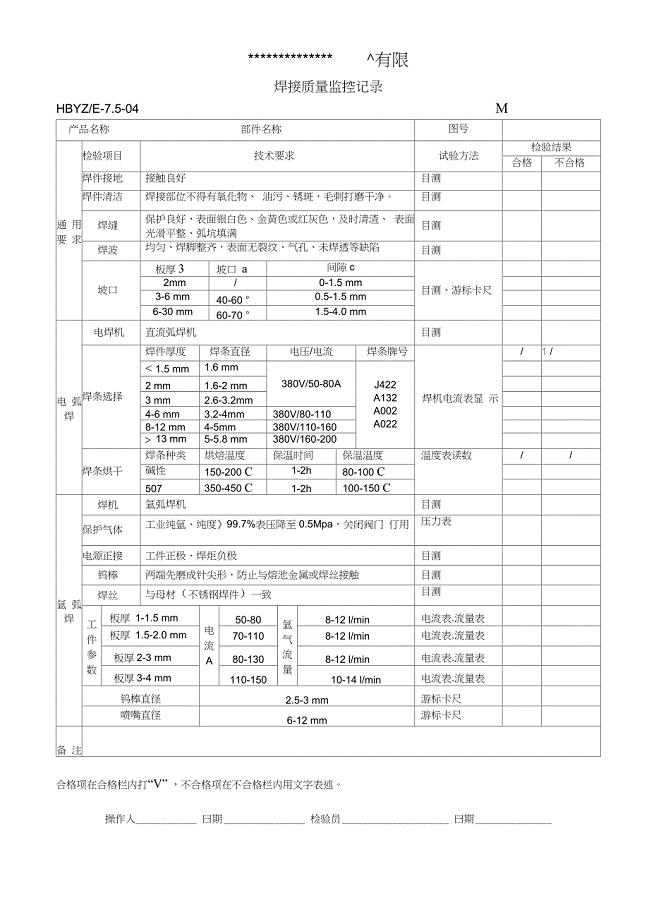
焊接质量监控记录

2023年幼儿园学期末家长会发言稿.docx
 2019门面房租赁合同范本【常用版】
2019门面房租赁合同范本【常用版】
2023-03-13 14页
 弄贯小学建档立卡户学生资助工作宣传简报
弄贯小学建档立卡户学生资助工作宣传简报
2023-09-22 3页
 酒店经营管理方案酒店经营管理方案
酒店经营管理方案酒店经营管理方案
2023-03-07 12页
 最新增值税纳税申报表(主表、附表一、附表二)
最新增值税纳税申报表(主表、附表一、附表二)
2023-07-06 4页
 青岛版三年级科学上册4《迁徙与冬眠》授课教案
青岛版三年级科学上册4《迁徙与冬眠》授课教案
2022-10-11 4页
 施工电梯防护棚方案
施工电梯防护棚方案
2023-04-05 10页
 北大博士研究生学位论文模板
北大博士研究生学位论文模板
2023-03-15 17页
 公司项目部管理人员绩效考核表
公司项目部管理人员绩效考核表
2024-02-25 24页
 普爱进修申请表卫生干部进修申请表.doc
普爱进修申请表卫生干部进修申请表.doc
2022-09-07 4页
 营运保障计划(BCP).doc
营运保障计划(BCP).doc
2023-07-02 6页

