
电镀知识讲座电镀基础知识
21页1、电镀知识讲座电镀基础知识2.1電鍍之定義電鍍(electroplating)被定義為一種電沈積過程(electro depos- ition process), 是利用電極(electrode)通過電流,使 金屬附著於物體表面上,其目的是在改變物體表面之特性 或尺寸。2.2電鍍之目的電鍍的目的是在基材上鍍上金屬鍍層(deposit),改變 基材表面性質或尺寸。例如賦予金屬光澤美觀、物品的防 鏽、防止磨耗、提高 導電度、潤滑性、強度、耐熱性、耐 候性、熱處理之防止滲碳、氮化、尺寸錯誤或磨耗之另件 之修補。2.3各種鍍金的方法電鍍法(electroplating)無電鍍法(electroless plating)熱浸法(hot dip plating)熔射噴鍍法(spray plating)塑膠電鍍(plastic plating)浸漬電鍍(immersion plating)滲透鍍金(diffusion plating)陰極濺鍍(cathode supptering)真空蒸著鍍金(vacuum plating)合金電鍍(alloy plating)複合電鍍 (composite plat
2、ing局部電鍍 (selective plating)穿孔電鍍(through-hole plating)筆電鍍(pen plating)電鑄 (electroforming)2.4電鍍的基本知識電鍍大部份在液體(solution)下進行,又絕大部份是由水溶 液(aqueous solution)中電鍍,約有30種的金屬可由水溶液 進行電鍍,由水溶液電鍍的金屬有:銅Cu、鎳Ni、鉻Cr、鋅Zn、鎘Cd 、鉛Pb、金Au、銀Ag、鉑Pt、鈷Co、錳Mn、銻Sb、鉍Bi、汞 Hg、鎵 Ga、銦 In、鉈、As、Se、Te、Pd、Mn、Re、Rh、Os、Ir、Nb、W 等。有些必須由非水溶液電鍍如鋰、鈉、鉀、鈹、鎂、鈣、 鍶、鋇、鋁、La、Ti、Zr、Ge、Mo等。可油水溶液及非水 溶液電鍍者有銅、銀、鋅、鎘、銻、鉍、錳、鈷、鎳等金屬。電鍍的基本知識包括下列幾項:溶液性質物質反應電化學化學式界面物理化學材料性質2.4.1 溶液(solution)被溶解之物質稱之為溶質(solute),使溶質溶解之液體 稱之溶齊劑(solute) o溶劑為水之溶液稱之水溶液(aqueous solution)
3、。表示溶質溶解於溶液中之量為濃度(concentration)。 在一定量溶劑中,溶質能溶解之最大量值稱之溶解度(solub ility)。達到溶解度值之溶液稱之為飽和溶液(saturated solu tion),反之為非飽和溶 液(unsaturated solution) o 溶液之濃 度,在工廠及作業現場,使用易了解及便利的重量百分率濃度(weight percentage)。 另外常用的莫耳濃度(molal concentration)。2.4.2 物質反應(reaction of matter)在電鍍處理過程中,有物理變化及化學變化,例如研 磨、乾燥等為物理反應,電解過程有化學反應,我們必須充 份了解在處裡過程中各種物理及化學反應及其相互間關係與影響。2.4.4 電化學(electrochemistry)電鍍是一種電沉積(electrodeposition )過程,利用電解體electrolysis)在電極(electrode)沉積金屬,它是屬於電化學之 應用的一支。電化學是研究有關電能與化學能交互變化作用及轉換過程。電解質(electrolyte)例子NaCl,也就是其溶
4、液具有電解 性質之溶液(electrolyticsolution)它含有部份之離子(ions),經 由此等離子之移動(movement)而能導電。帶陰電荷朝向陽極(anode)移動稱之為陰離子(ani on),帶正電荷朝向陰極(cathode)移動(migrate)者稱之為陰離 子cations)。這些帶電荷之粒子(particles)稱之為離子(ions)。放出電 子產生氧化反應之 電極稱之為陽極(anode)得到電子產生還元化應之電極稱之 為陰極(cathode)。整個反應過程稱之為電解(electrolysis)。2.4.4.1 電極電位(electrode potentials)電位(electrode potential)為在電解池(electrolytic)中之 導電體,電流 經由它流入或流出。電極電位(electrode poten tial)是電極與電解液之間的電動勢差,單獨電極電位不能測定需參考一些標準電極(standard electrode)。例如氫標準電極(hydrogen standard electrode)以其 為基準電位為0電極電位之大小可由Nernst
《电镀知识讲座电镀基础知识》由会员cn****1分享,可在线阅读,更多相关《电镀知识讲座电镀基础知识》请在金锄头文库上搜索。

论法治与和谐社会分析研究 社会学专业

副校长学期工作计划范本(二篇).doc

科目二考试系统原理

兰州大学21春《计算机组成原理》在线作业二满分答案_16

2023年产品销售合同552.docx

2023年公司旅游横幅标语.docx

相似的图形与成比例线段学案

三和厂房消防施工组织设计

中班数学教案及教学反思3的组成

2023年幸福的瞬间作文范文.docx
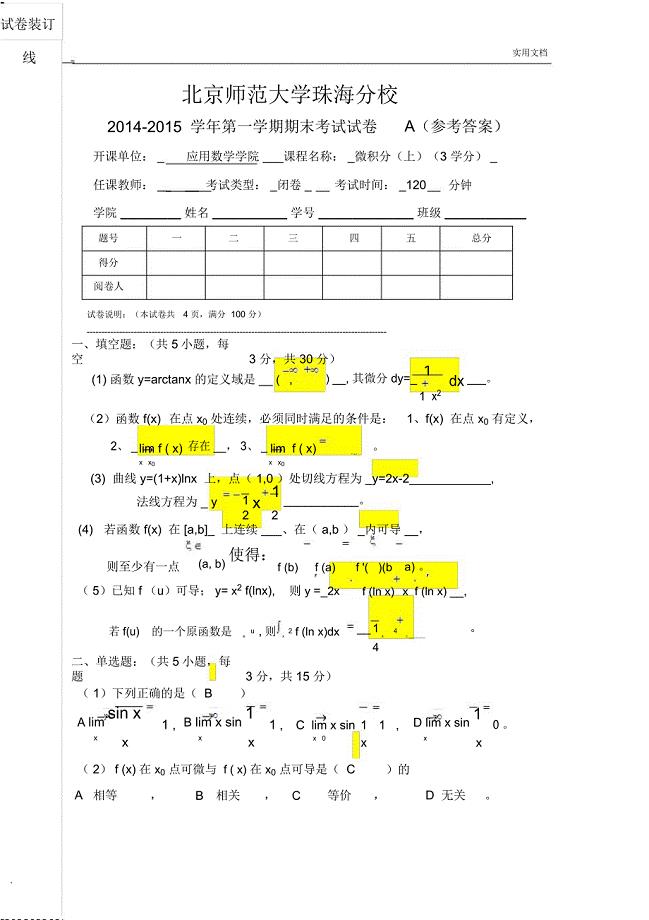
微积分期末试卷答案

(部编)人教版初中九年级历史上册《第14课文艺复兴运动》公开课教案_0

2023年养成教育心得体会3篇.docx

2023年宣传部干事规章制度.docx
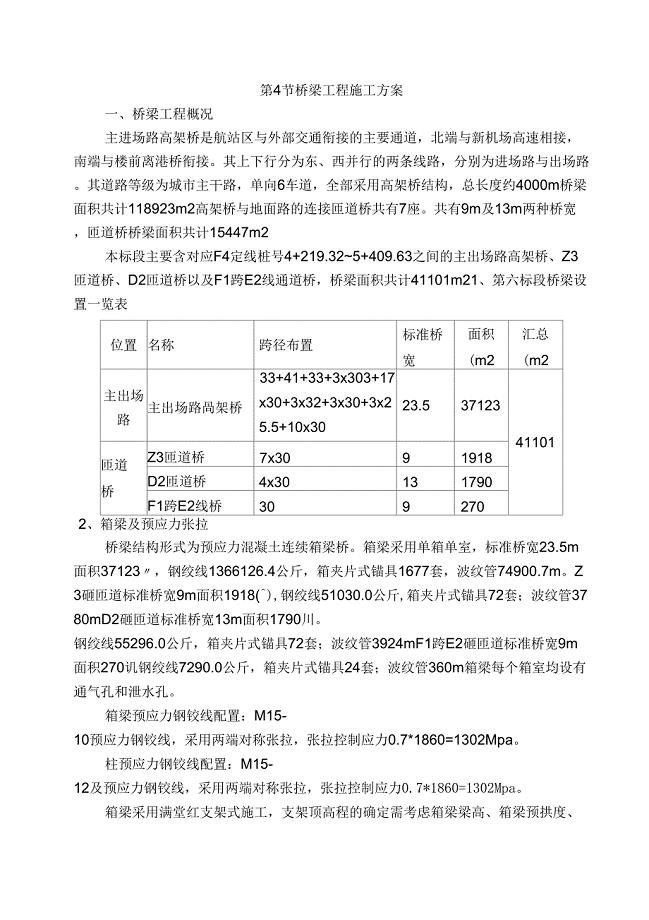
桥梁工程施工方案

2023年商业公司管理工作总结.docx

2走一步再走一步.doc

2023年下半年上海会计从业资格财经法规真题

2023年六年级英语下复习资料单词归类.docx

2023年有关护理毕业生介绍信范本.docx
 科目二考试系统原理
科目二考试系统原理
2023-12-19 3页
 山体滑坡的危害及应对措施
山体滑坡的危害及应对措施
2023-10-02 9页
 薄膜电阻和厚膜电阻的区别
薄膜电阻和厚膜电阻的区别
2024-01-11 3页
 有效沟通管理方法
有效沟通管理方法
2024-02-10 9页
 最新非煤矿山应急预案
最新非煤矿山应急预案
2023-03-04 50页
 脑梗患者的日常护理和脑梗塞的预防
脑梗患者的日常护理和脑梗塞的预防
2023-04-17 2页
 民航飞机电气仪表及通信系统习题
民航飞机电气仪表及通信系统习题
2022-07-25 8页
 二茂铁柴油实验报告完成版
二茂铁柴油实验报告完成版
2022-09-23 11页
 桥梁工程施工方案
桥梁工程施工方案
2023-03-14 50页
 大学必修 教育学
大学必修 教育学
2023-10-21 8页

