
实验七 乙酸乙酯皂化反应速率常数的测定[实验相关]
5页1、实验七 乙酸乙酯皂化反应速率常数的测定日期:2008-06-18来源: 作者:字体:大 中 小乙酸乙酯皂化反应速率常数的测定一、目的及要求 1、测定皂化反应中电导的变化,计算反应速率常数。 2、了解二级反应的特点,学会用图解法求二级反应的速率常数。 3、熟悉电导率仪的使用。二、原理乙酸乙酯的皂化反应为二级反应:CH3COOC2H5+NaOH=CH3COONa+C2H5OH在这个实验中,将CH3COOC2H5和NaOH采用相同的浓度,设a为起始浓度,同时设反应时间为t时,反应所生成的CH3COONa和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度为(ax),即CH3COOC2H5+NaOH= CH3COONa+ C2H5OHt=0时, a a 0 0t=t时, a-x a-x x xt时, 0 0 a a其反应速度的表达式为:dx/dt=k(a-x)2k反应速率常数,将上式积分,可得kt=x/a(a-x) *乙酸乙酯皂化反应的全部过程是在稀溶液中进行的,可以认为生成的CH3COONa是全部电离的,因此对体系电导值有影响的有Na+、OH-和CH3COO-,而Na+、在反应
2、的过程中浓度保持不变,因此其电导值不发生改变,可以不考虑,而OH-的减少量和CH3COO-的增加量又恰好相等,又因为OH-的导电能力要大于CH3COO-的导电能力,所以体系的电导值随着反应的进行是减少的,并且减少的量与CH3COO-的浓度成正比,设L0反应开始时体系的电导值,L反应完全结束时体系的电导值,Lt反应时间为t时体系的电导值,则有 t=t时, x=k(L0-Lt)t时, a=k(L0-L)k为比例系数。代入*式得Lt=1/ka(L0-Lt)/t+ L以Lt对(L0-Lt)/t作图,得一直线,其斜率为1/ka,由此求得k值。三、实验仪器和试剂 恒温水浴一套,电导率仪一台,秒表一只,羊角型电导池一支,移液管一支,试管一只,移液管(10mL)二只,移液管(2mL带刻度)一只,容量瓶(50mL)一只,容量瓶(1000mL)一只,0.1mol NaOH溶液,乙酸乙酯(A.R)分子量88.11,密度0.9002L/ml)。K1:电源开关 K4:校正调节 K7:电极常数调节K2:高周、低周开关 K5:量程选择开关 C1:电极插口 K3:校正、测量开关 K6:电容补偿调节 C2:10毫伏输出
《实验七 乙酸乙酯皂化反应速率常数的测定[实验相关]》由会员m****分享,可在线阅读,更多相关《实验七 乙酸乙酯皂化反应速率常数的测定[实验相关]》请在金锄头文库上搜索。

大连理工大学21春《机械工程材料》在线作业二满分答案_21

2023教师继续教育培训工作总结范文.docx

承载力参考经验值

统计局2023年全市人才工作座谈会汇报发言材料.docx

2023年综合素质评价工作总结.DOC

2023年了不起的爸爸作文.docx

浅谈精细化管理试卷教案.doc

建筑资料员实习报告
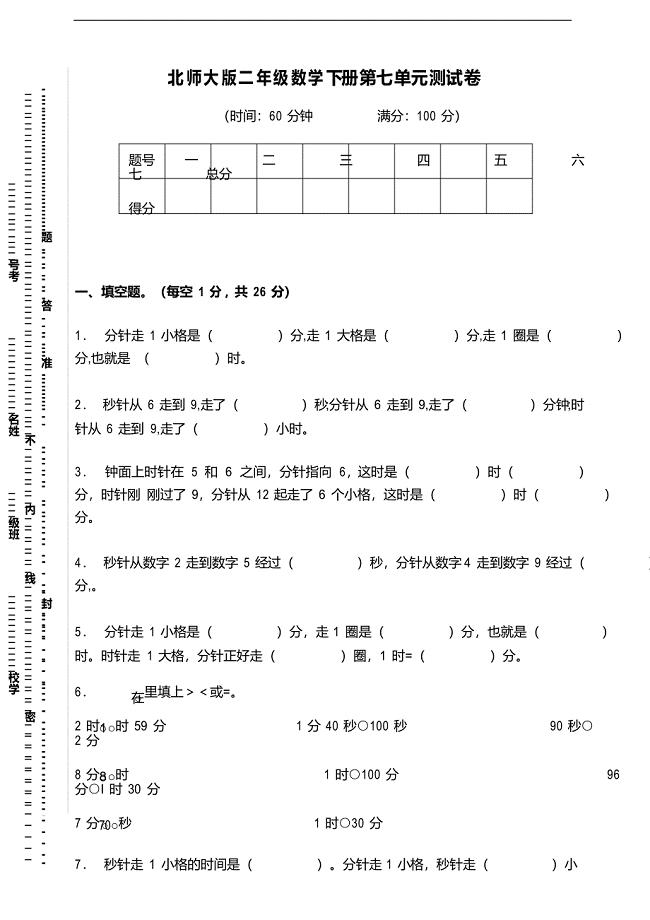
北师大版二年级数学下册第七单元测试卷

2023年写父爱作文1.docx

湖南省张家界市桑植县2016_2017学年八年级语文下学期期中试题新人教版.doc

2023难忘初中生活作文范文.docx

2023年世界水日的演讲稿2.docx

《培根随笔》读后感_7

二年级数学下学期期末考试题2 西师大版

2023年秋雨的日记范文.docx

2023清明节周记39范文.docx

2023建筑合同868范文.docx

家乡的变化真大呀.docx

珠海某大学校区污水处理系统改造土建工程施工组织设计DOC109页
 断路器的种类与选择.doc
断路器的种类与选择.doc
2023-06-04 7页
 后期合成技术在动画中的运用.docx
后期合成技术在动画中的运用.docx
2024-01-07 5页
 吸音板规范要求
吸音板规范要求
2023-11-20 4页
 中小学生安全知识竞赛.docx
中小学生安全知识竞赛.docx
2023-08-14 21页
 小学二年级主题作文10篇(实用)
小学二年级主题作文10篇(实用)
2023-04-26 6页
 《骆驼祥子》读书笔记怎么写150字5篇范文
《骆驼祥子》读书笔记怎么写150字5篇范文
2022-11-02 6页
![[推荐]荧光灯质量工艺分析](/Images/s.gif) [推荐]荧光灯质量工艺分析
[推荐]荧光灯质量工艺分析
2023-11-06 25页
 向阳煤业学习心得
向阳煤业学习心得
2022-10-11 4页
 001-曳引驱动电梯安装试运行技术交底卡.doc
001-曳引驱动电梯安装试运行技术交底卡.doc
2022-10-07 4页
 BYOD日益普及,移动用户安全意识却滞后.doc
BYOD日益普及,移动用户安全意识却滞后.doc
2022-11-16 9页

