
【化学】配合物与超分子第一课时课件 2023-2024学年高二化学人教版(2019)选择性必修2
28页1、第三章晶体结构与性质第四节第四节配合物与超分子配合物与超分子(第第1 1课时)课时)无水CuSO4固体是白色的,但CuSO4水溶液和CuSO45H2O晶体却是蓝色的,为什么呢?CuSO4 固体固体 CuSO4溶液溶液 CuSO45H2O晶体晶体思考讨论 演示【实验3-2】观察下列固体和溶液的颜色,填写下表,分析什么离子呈天蓝色?固体颜色CuSO4白色CuCl2绿色CuBr2深褐色NaCl白色K2SO4白色KBr白色溶液颜色无色离子什么离子呈天蓝色SO42 Na+ClK+Br无色无色无色天蓝色天蓝色天蓝色Cu(H2O)42+Cu2+?四水合铜离子Cu2+与H2O间是通过什么化学键形成Cu(H2O)42+呢?观察思考Cu(H2O)42+的形成过程激发杂化H2OH2OH2OH2OCu(H2O)42+平面正方形平面正方形配位键孤电子对29CuAr3d104s1失去2e-29Cu2+Ar3d9价层电子排布图一、配位键:(1)概念:成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。Cu2+4H2O=Cu(H2O)42+(蓝色蓝色)电子对接受体(空轨道
2、)孤电子对(电子对给予体)配位键(2)表示方法:配位键可以用AB或AB来表示。A表示提供孤电子对的配体 B表示提供空轨道的中心(原子)离子或或四水合铜离子(3)配位键特点:配位键是一种特殊的共价键(本质也是键),具有方向性和饱和性。例如:依据反应 NH3+H+=NH4+,讨论NH3是如何与H形成NH4的?思考讨论写出H3O+的配位键的表示法?与铵根类似,将氢离子换成铜离子:二、配位化合物:(1)概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。(2)组成:配合物由内界和外界构成,配合单元是内界,内界由中心离子(原子)和配体构成。外界是带异号电荷的离子。内界外界中心离子配体配位数配位原子常见的中心原子(离子)提供空轨道。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。部分主族元素,如H+、Al3+、B等)常见的配位体提供孤电子对原子:N O P S,一般是A A A的非金属原子分子CO、NH3、H2O等阴离子:X-(卤素离子)、CN-、OH-、SCN-等
3、。u配位化合物一定含有配位键,u但含有配位键的化合物不一定是配位化合物。例如:CO、NH4Cl等等NH4Cl是配合物吗?思考讨论配合物配合物内界内界外界外界中心粒子中心粒子配位体配位体配位数配位数Ag(NH3)2OHK3Fe(CN)6Co(NH3)5ClCl2 Ni(CO)4请根据给出的配合物完成下表思考讨论配合物配合物内界内界外界外界中心粒子中心粒子配位体配位体配位数配位数Ag(NH3)2OH氢氧化二氨合银氢氧化二氨合银K3Fe(CN)6Co(NH3)5ClCl2 Ni(CO)4Ag(NH3)2OH-Ag+NH32请根据给出的配合物完成下表思考讨论配合物配合物内界内界外界外界中心粒子中心粒子配位体配位体配位数配位数Ag(NH3)2OH氢氧化二氨合银氢氧化二氨合银Ag(NH3)2OH-Ag+NH32K3Fe(CN)6六氰合铁酸钾六氰合铁酸钾Fe(CN)63KFe3CN6Co(NH3)5ClCl2 Co(NH3)5Cl2ClCo3NH3、Cl6Ni(CO)4四羰基镍四羰基镍Ni(CO)4无无NiCO4请根据给出的配合物完成下表思考讨论配合物结构小结:1、配合物有些存在外界、有些无外界;2
《【化学】配合物与超分子第一课时课件 2023-2024学年高二化学人教版(2019)选择性必修2》由会员s****6分享,可在线阅读,更多相关《【化学】配合物与超分子第一课时课件 2023-2024学年高二化学人教版(2019)选择性必修2》请在金锄头文库上搜索。

【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册

【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3

【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
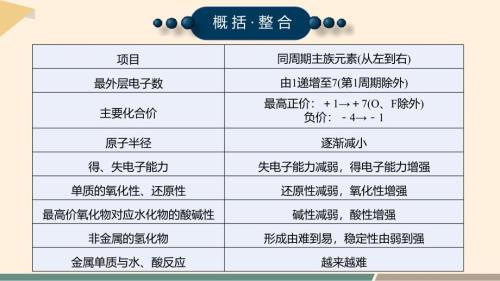
【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
【化学】能量转化的应用——化学电池课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学键与物质构成课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应与能量转化 化学能与热能课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的限度课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】化学反应的快慢课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【化学】分子间作用力课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修2

【化学】电极方程式书写课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册

【地理】服务业区位因素及其变化 教学设计2023-2024学年高中地理人教版(2019)必修二

【化学】盐化肥检测题-2023-2024学年九年级化学人教版下册

【化学】金属和金属材料测试题----2023-2024学年九年级化学人教版下册
 【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】原子结构 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 47页
 【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】元素周期律课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 27页
 【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册
【化学】元素周期表课件 2023-2024学年高一下鲁科版(2019)必修第二册
2024-05-21 44页
 【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
【化学】有机物分子中共面问题课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
2024-05-21 19页
 【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
【化学】烯烃炔烃的性质课件 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
2024-05-21 19页
 【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】微项目 课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 22页
 【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
【化学】微项目 补铁剂中铁元素的检验——利用配合物进行物质检验课件 高二下鲁科版(2019)选择性必修2
2024-05-21 17页
 【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】同主族元素的相似性和递变性课件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 41页
 【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
【化学】认识同周期元素性质的递变规律件 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
2024-05-21 36页
 【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
【化学】醛和酮 糖类和核酸课件 2023-2024学年高二化学人教版(2019)选择性必修2
2024-05-21 39页

