
制氢装置变换工艺教材
21页1、 制氢装置变换工艺教材烃类蒸汽催化转化气体中,CO的浓度大约为1215%,CO不是产品,但 CO和水蒸气反应可生成H2,这就是一氧化碳的变换反应。在烃类蒸汽转化工艺过程中,CO(以及CO2)的彻底脱除通常采用PSA或甲烷化法,甲烷化法必须消耗一定量的H2,CO含量越高,则耗氢量越多。显然,变换后气体中残余CO含量越低,则有效气体H2产量越高,即原料烃的利用率越高,单位氢耗越低。变换工段的任务就是要最大限度地提高CO的变换率,即尽可能地降低CO的最终残余浓度。1.变换反应原理一氧化碳和水蒸气的变换反应用下列方程式表示: COH2OCO2H2Q变换反应在变换催化剂的参与下才具有工业意义,它是一个可逆的放热的气固相催化反应,反应前后体积无变化。变换反应的热效应与反应温度有关,反应温度提高,热效应减小。在变换反应过程中,除了上述主反应外,还可能发生下列副反应: 2COCCO2 (1) CO3H2CH4H2O (2) COH2CnHm (3) CO2H2CH3OH (4)反应(1)是放热和体积缩小的反应,在200500的温度下,该反应的速度极慢。因此在正常的工艺条件下,可以抑制这一副反应的发生。
2、其他副反应是难于完全避免的,但控制适宜的工艺条件可大大减缓这些副反应的进行。衡量CO变换反应进行程度的参数,通常用CO变换率来表示,变换率的定义是:经变换反应后,反应了的CO的量与反应前气体中的CO的总量之比,变换率可用下式表示: X(ab)/a100%式中 XCO变换率 a变换前气体中CO的量 b变换后气体中CO的量在实际生产中,变换气体中除含有CO2、H2、N2等成分。变换率可根据变换反应前后气体组成的变化进行计算。例如可根据变换反应前后气体中CO浓度的变化来求变换率。设变换反应前后气体中CO的浓度(干基)分别为V1和V2,则由反应方程式可得出下式: V2(V1V2)/(1XV1)100%式中X为变换率,V1和V2分别为变换反应前后气体中CO的浓度(体积百分数)。上式经整理后可得到变换率X的计算公式 X(V1V2)/ V1(1V2) 100%一氧化碳变换反应是一个可逆放热反应,平衡常数是温度的函数,随温度的增加而降低。在一定条件下,变换反应达到平衡时的变换率称为平衡变换率或理论变换率,很显然,平衡变换率是该条件下可以达到的最大变换率,实际生产中的变换率总是小于平衡变换率。2.影响因
3、素和工艺条件的选择2.1温度因为变换反应是一个可逆的放热反应,因此,温度对于反应平衡和反应速度是一个矛盾因素。从反应平衡角度出发,温度越高,平衡常数越小,残余CO浓度越高,变换率越低。因此,为提高变换率,即降低CO最终残余浓度,降低反应温度是一个关键因素。但变换反应温度的降低是有限的,一是受变换催化剂起始活性温度的限制,反应温度应略高于活性起始温度;二是受工艺气露点温度的限制,在高水碳比下操作的转化工艺气,其水蒸气分压较大,露点温度也较高。变换催化剂是不允许冷凝水进入的,因此,一般要求入炉温度高于露点温度20以上。但从反应动力学角度出发,提高温度可加大反应速度;但反应温度与反应速度并非呈直线关系。因为变换反应是一个可逆反应,提高温度可同时加快正、逆两个方向的反应,总反应速度为正、逆两个反应速度之差,在变换反应刚开始时,由于气体中CO浓度较高,反应远离平衡,此时提高反应温度,反应速度将显著增大,主要是正反应速度提高很快,但随着反应的进行,CO浓度逐步降低,距离平衡越来越近,此时在提高反应温度,由于逆反应速度的增大更明显,总反应速度的提高已相对减弱。由此可见,对应于一定的气体组成,有一个最
4、适宜的反应温度,很明显,这个最适宜的反应温度是随变换反应的进行而逐渐降低的。在入口气体组成一定的情况下,最适宜反应温度的连线称为最适宜反应温度线,它的走向是随着反应的进行由高向低的。完全沿着最适宜温度线进行操作,即一开始的反应温度最高,然后逐步降低,实际生产是困难的,它受到催化剂活性、入口气体的预热、反应热的移走等等方面的制约。因此,实际生产不可能完全按照最适宜反应温度线进行操作。实际生产中解决温度对反应平衡和反应速度这一矛盾因素的方法,是将变换反应分段进行,多采用二段或三段绝热反应,段间冷却的方法。第一段反应在较高的温度下进行,因为此时气体中CO浓度较高,以提高反应速度使大部分CO迅速变换为目的;第二段反应在较低温度下进行,以提高变换率和降低最终残余CO浓度为目的。两段变换的温度选择和控制,以两段变换催化剂的活性温度范围为主要依据。第一段高温变换温度范围约为360450,第二段低温变换温度范围约为190240。2.2压力从变换反应方程式可以看出,变换反应前后气体总体积不变,因此在不太高的压力范围内,压力对变换反应的平衡影响很小,但在较高的压力下,压力对平衡常数有影响。压力对变换反应速
《制氢装置变换工艺教材》由会员万****分享,可在线阅读,更多相关《制氢装置变换工艺教材》请在金锄头文库上搜索。

排水整治工程确保安全生产的技术组织措施

隧道辖区道路清扫保洁劳务保洁服务针对低温天气作业应急预案

电气安装焊接工程强制性条文执行情况检查表

隧道辖区道路清扫保洁劳务保洁服务项目机械化保洁及垃圾清运过程应急处理预案

隧道辖区道路清扫保洁劳务保洁服务应急救援保障措施

城镇燃气经营安全重大隐患判定标准

市政道路及各项基础设施配套项目项目管理班子的人员岗位职责分工

养驴基地建设项目建设的有利条件和制约因素

养驴基地建设项目区基本情况及项目由来

锅炉受热面焊接工程强制性条文执行情况检查表

锅炉受热面焊接工程强制性条文执行情况检查表 (2)

烟风煤粉管道及附属结构焊接专业强制性条文执行情况记录检查表

养驴基地建设项目财务评价方案
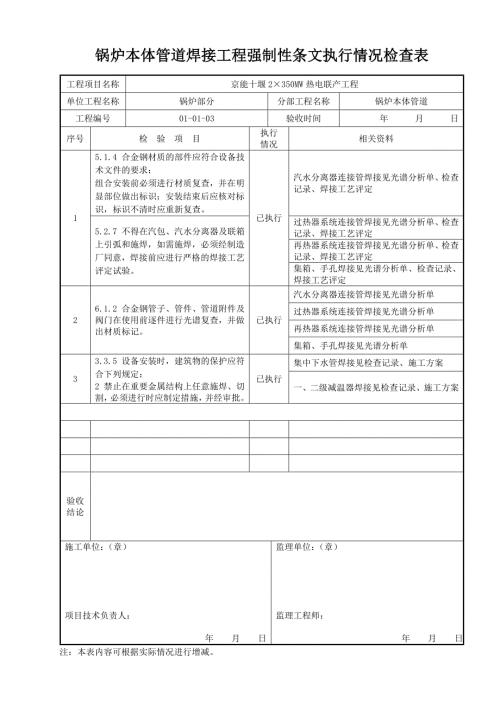
锅炉本体管道焊接工程强制性条文执行情况检查表 (2)

养驴基地建设项目环境保护评价方案

锅炉本体管道焊接工程强制性条文执行情况检查表

锅炉密封焊接工程强制性条文执行情况检查表 (2)

养驴基地建设项目建设内容方案

锅炉密封焊接工程强制性条文执行情况检查表 (3)

养驴基地建设项目管理方案
 消防控制室操作人员考试题(含答案).docx
消防控制室操作人员考试题(含答案).docx
2022-12-29 4页
 星级酒店保安、安全培训资料全套
星级酒店保安、安全培训资料全套
2022-12-20 61页
 研发管理制度;
研发管理制度;
2022-09-23 6页
 学校疫情期间错时上放学工作方案.
学校疫情期间错时上放学工作方案.
2022-10-26 7页
 《关于柳州仔螺蛳粉市场调研报告》
《关于柳州仔螺蛳粉市场调研报告》
2023-07-20 5页
 2020年维修工个人工作总结5篇
2020年维修工个人工作总结5篇
2023-08-20 8页
 2021年幼儿园保健工作计划范文.doc
2021年幼儿园保健工作计划范文.doc
2023-04-11 4页
 福建省厦门市思明区东埔学校2020学年八年级英语下学期期末考试试题(无答案) 人教新目标版
福建省厦门市思明区东埔学校2020学年八年级英语下学期期末考试试题(无答案) 人教新目标版
2024-01-21 10页
 云南省中医师承和确有专长考核考试相关表格.docx
云南省中医师承和确有专长考核考试相关表格.docx
2024-01-13 17页
 混合高斯背景建模matlab代码
混合高斯背景建模matlab代码
2022-09-08 3页

