
高中化学方程式大全
6页1、优质名校 第 - 1 - 页 共 1 页高中无机化学方程式1碱金属及碱土金属元素4Li+ O2 2Li2O (常温、点燃产物相同)条件不同,产物不同4Na+O2=2Na2O Na2O2+2Na2Na2O(此反应用于制备Na2O)2Na2O+ O2 Na2O24Na+2O22Na2O2 K+ O2KO2 2Na+S=Na2S(加热可以爆炸) 2Na+2H2O=2NaOH+H2(Na不能把金属从水溶液中置换出来,除了酸,一般是先和水反应) 2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)=4NaCl+Ti Na+KCl(熔融)=NaCl+KNa2O+H2O=2NaOH (与下式对比,同物质的量设计反应浓度相同题) 2Na2O2+2H2O=4NaOH+O2(歧化反应,水不是氧化剂或还原剂)( 此反应分两步:Na2O2+2H2O=2NaOH+H2O2 2H2O2=2H2O+O2.使酚酞溶液先红后退色 )Na2O+CO2=Na2CO3 (碱性氧化物与酸性氧化物生成盐)2Na2O2+2CO2=2Na2CO3+O2(无)反应现象对比不同,Na2CO3两阶段反应NaHCO3与NaHCO
2、3都可产生CO2Na2CO3+HCl=NaHCO3+NaCl NaHCO3+HCl=NaCl+H2O+CO2Na2CO3+2HCl=2NaCl+ H2O+ CO2 2NaHCO3 Na2CO3+ H2O+ CO2(考查试剂变质,类似有Na2SO3变质)NaHCO3 + NaOH= Na2CO3 + H2O (易考离子方程式书写,强调不会生成CO2) Ca(HCO3)2 + NaOH(少)=CaCO3+ H2O+NaHCO3 Ca(HCO3)2 + 2NaOH(多)=CaCO3+ 2H2O+Na2CO3 Ca(OH)2 + NaHCO3(少)=CaCO3+ H2O+ NaOH易考离子方程式 Ca(OH)2 + 2NaHCO3(多)= CaCO3 + 2H2O+Na2CO3 NaHSO4 +Ba(OH)2 =BaSO4 + H2O+ NaOH(恰好完全生成沉淀) 2NaHSO4 +Ba(OH)2 =BaSO4 + 2H2O+ Na2SO4(恰好溶液呈中性) 2NH4HCO3 + 2NaOH(少)= 2H2O+Na2CO3 +(NH4)2CO3 NH4HCO3 + 2NaOH(多)= Na2
3、CO3 +NH3+2H2O 2Ca(OH)2 + Mg(HCO3)2 = Mg(OH)2+2CaCO3 + 2H2O(不是生成 MgCO3) Na2CO3+ H2O+ CO2 = 2NaHCO3 Na2CO3(饱和)+ H2O+ CO2 = 2NaHCO3 Na2SO4H2SO4=2NaHSO4 较易联合在一起考查计算,反应物介于2:1和1:1之间,5种情况,4种结果,或考查图像题向NaOH与Ca(OH)2混合溶液中通CO2分阶段反应 2NaOH+ CO2 (少量)= Na2CO3 + H2O NaOH+ CO2(多量)= NaHCO3 CO2+Ca(OH)2(过量)=CaCO3+H2O CaCO3+H2O +CO2=Ca(HCO3)2 2CO2(过量)+Ca(OH)2=Ca(HCO3)2 2NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(足量)=NaHSO3 NaOH+HCl=NaCl+H2O NaOH+H3PO4=NaH2PO4+H2O 2NaOH+H3PO4=NaHPO4+2H2O 3NaOH+H3PO4=Na3PO4+3H2O NaOH+H2S(足量)=NaH
《高中化学方程式大全》由会员pu****.1分享,可在线阅读,更多相关《高中化学方程式大全》请在金锄头文库上搜索。
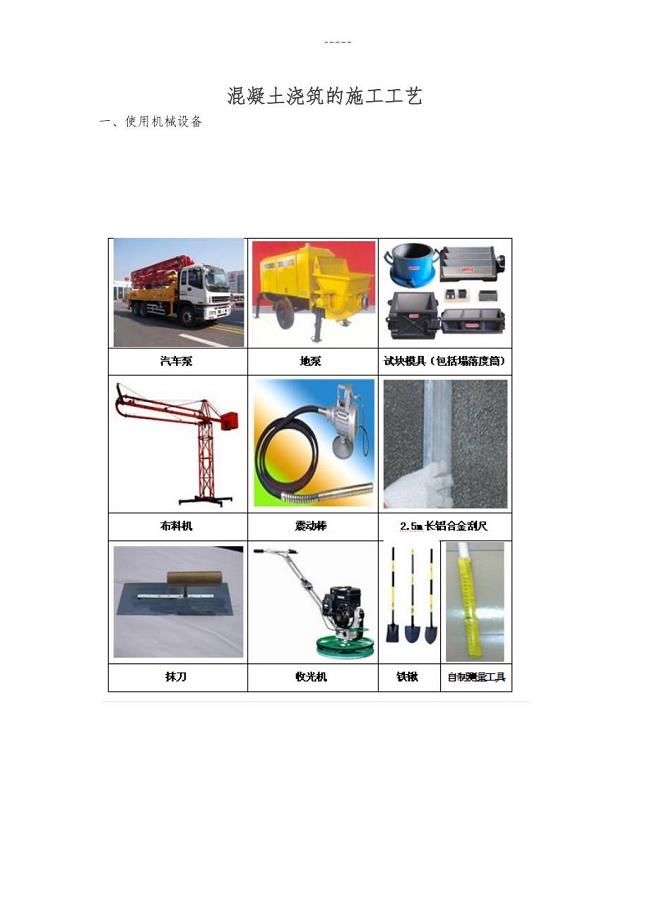
混凝土浇筑的施工工艺设计

汉语言文学修辞学重点

同济大学金工实习报告

在开展整作风提效能优环境动员大会上的讲话讲话稿

2023年行走在童心的世界幼师演讲稿范文.docx

关于过程重要还是结果重要辩论题材

信用社主任个人总结.docx

调研小组##年工作总结范文.docx

2022学年辽宁省葫芦岛市连山区物理八年级第二学期期末学业水平测试试题(含解析).doc

业主自治团体运行机制研究

厨工年终个人工作总结.doc

2023年为做快乐的自己我执著培训学习心得体会.docx

大连理工大学21秋《新能源发电》在线作业三满分答案95

2022年安全员技术个人工作总结

xx党委两学一做检查汇报材料

太平河拖拉管注浆施工方案完整

2022届兴义市第八中学高三冲刺模拟英语试卷(含解析).doc

2023年教师专业技术度工作总结范文.docx

2023年成长的烦恼作文800字.docx

2023年学度第一学期教科研工作计划.docx
 浅谈孩子注意力的培养
浅谈孩子注意力的培养
2023-12-04 2页
 没有人喝彩的工作二年级作文
没有人喝彩的工作二年级作文
2023-09-14 2页
 五年级作文阅读小练笔
五年级作文阅读小练笔
2022-12-07 5页
 毕业论文范文
毕业论文范文
2022-08-17 13页
 小学常识第06册教案(浙教版)
小学常识第06册教案(浙教版)
2023-03-23 27页
 新建MicrosoftWord文档(3)
新建MicrosoftWord文档(3)
2022-10-18 2页
 八年级上短语.doc
八年级上短语.doc
2024-02-12 19页
 高二上生物期中试卷
高二上生物期中试卷
2023-07-18 13页
 九年级数学期末测试题
九年级数学期末测试题
2023-10-10 2页
 长方形的面积练习纸
长方形的面积练习纸
2022-08-29 2页

