
新编高考化学新课标一轮复习讲义:元素周期表和元素周期律(含解析)
19页1、新编高考化学备考资料第二节元素周期表和元素周期律1.掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。(中频)2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。(高频)3.以A和A族为例,掌握同一主族内元素性质递变规律与原子结构的关系。(高频)4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。(高频)元素周期表1编排原则2结构(1)周期(7个横行,7个周期)短周期长周期序号1234567元素种数288181832320族元素原子序数21018365486118(2)族(18个纵行,16个族)主族列序121314151617族序AAAAAAA副族列序345671112族序BBB B BBB第族第8、9、10共3个纵行0族第18纵行说明:镧系在六周期B族,共15种元素,锕系在七周期B族,共15种元素。元素周期律1元素周期律(1)内容元素的性质随原子序数的递增而呈周期性变化的规律。(2)实质元素原子核外电子排布周期性变化的结果。(3)元素周期表中主族元素性质的递变规律原子半径主要化合价:元素的金属性元素的非金属性2元素周期表和元素周期律的应
2、用(1)元素周期表中元素的分区金属性最强的元素位于元素周期表左下角,是铯元素。非金属性最强的元素位于元素周期表右上角,是氟元素。(2)科学预测为新元素的发现及预测它们的原子结构和性质提供线索。(3)寻找新材料将下面左右两侧对应内容连线。 【答案】cab1易误诊断(正确的打“”,错误的打“”)。(1)A族全部是金属元素()(2)同一主族元素的原子半径随着电子层数的增多而增大()(3)最外层电子数相同的元素一定都在同一族()(4)根据主族元素最高正化合价与族序数的关系,推出卤族元素最高价都是7价()(5)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素()(6)同一主族元素的单质随着原子序数的增大,熔沸点均增大()(7)第3周期元素的最高化合价等于它所处的主族序数()(8)酸性:H3PO4H2SO4HClO4()(9)氢化物的稳定性:H2SHFH2O()(10)元素的性质随相对原子质量的递增呈现周期性的变化()【答案】(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)2比较下列各性质(填“”或“(2)(3)(4)(5)3现有元素:Na、Mg、Al、S、Cl。(1)五种元
3、素的原子半径由大到小的顺序为_。(2)Na、Mg、Al单质置换水或酸中的氢,由易到难的顺序为_;最高价氧化物对应水化物的碱性由强到弱的顺序为_。(3)S、Cl2与氢气化合时,由易到难的顺序为_,气态氢化物的稳定性由强至弱的顺序为_,最高价氧化物对应水化物的酸性由强至弱的顺序为_。【答案】(1)NaMgAlSCl(2)Na、Mg、AlNaOH、Mg(OH)2、Al(OH)3(3)Cl2、SHCl、H2SHClO4、H2SO4元素周期表中三个七,二个一:即7个周期,7个主族,7个副族;二个特殊的族:1个族和1个零族。,周期表中各族的排列顺序:A、A、B、B、B、B、B、B、B、A、A、A、A、A、0。原子结构与周期表关系的4个关系式:(1)质子数原子序数;(2)电子层数周期序数;(3)最外层电子数主族序数;(4)最低负价主族序数8。周期表中的2个递变规律:(1)同周期(从左到右)(2)同主族(从上到下)金属性强弱的4个判据:(1)单质与H2O或H反应难易,(2)置换反应,(3)阳离子的氧化性,(4)最高价氢氧化物的碱性。非金属性强弱的4个判据:(1)单质与H2化合的难易,(2)置换反应,(
《新编高考化学新课标一轮复习讲义:元素周期表和元素周期律(含解析)》由会员桔****分享,可在线阅读,更多相关《新编高考化学新课标一轮复习讲义:元素周期表和元素周期律(含解析)》请在金锄头文库上搜索。

2023年创业培训研结范文.doc

生产管理述职报告

2023年公司关于复工后新型冠状病毒感染的肺炎疫情防控工作应急预案.doc
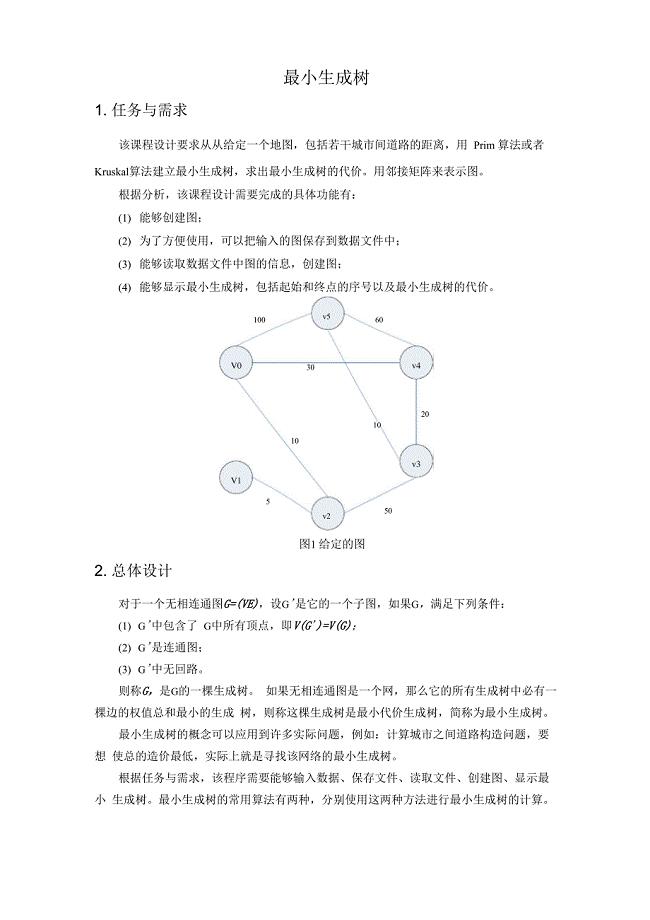
课程设计-最小生成树

2023年小学教师值周工作总结.docx

2023年劳动合同有几种.docx

2023年餐厅销售经理述职报告2.docx

2023年律师事务所实习报告5000字总结范文五篇.docx

2022学年无锡市重点中学毕业升学考试模拟卷英语卷(含答案解析).doc

2023年以人为本构建新时期人口与计划生育新机制2.docx

2023年新闻专业毕业生实习自我鉴定样本.docx

年市委市政府办公室作风建设工作总结

2023年工厂小品抢修在线范文.doc

2023年开学第一课观后感总结(2篇).doc

2023年广播广告文稿类型的小品式.docx

2023年乡镇人口与计划生育工作总结2.docx

房产委托协议书(2篇).doc

2023年村组河塘清淤整治工作汇报新编.docx

2023年大学生下乡工作自我鉴定.docx

谁不说俺家乡好.doc
 专题讲座资料(2021-2022年)抚顺天然气综合利用项目站场仪表自动化专业安装施工方案
专题讲座资料(2021-2022年)抚顺天然气综合利用项目站场仪表自动化专业安装施工方案
2022-11-20 81页
 我国土地利用管理中存在的问题及对策
我国土地利用管理中存在的问题及对策
2022-10-03 5页
 某公司质量环境职业健康安全管理手册(DOC 46页)
某公司质量环境职业健康安全管理手册(DOC 46页)
2023-02-06 42页
 StringBuffer的一些方法
StringBuffer的一些方法
2024-02-13 3页
 V2视频会使用说明
V2视频会使用说明
2023-10-25 18页
 最新《施工组织设计》沥青砂浆施工方案8
最新《施工组织设计》沥青砂浆施工方案8
2023-11-28 11页
 暖气片的连接方式
暖气片的连接方式
2023-04-17 5页
 外资注册可行性报告文档(标准版)7篇(DOC 10页)
外资注册可行性报告文档(标准版)7篇(DOC 10页)
2023-05-13 10页
 xx党委两学一做检查汇报材料
xx党委两学一做检查汇报材料
2022-11-26 7页
 【最新资料】上海市静安区高三上学期期末教学质量检测数学理试题
【最新资料】上海市静安区高三上学期期末教学质量检测数学理试题
2023-04-29 9页

