
化学平衡状态的判断方法及练习
3页1、化学平衡状态的判断方法直接判断法1. 等:(1)用同一种物质来表示反应速率时,V正=V逆 ,即单位时间内生成与消耗某反应物(或生成物)的量相等,或单位时间内化学键断裂量等于化学键的形成量。(2)用不同种物质来表示反应速率时要注意 (i)表示两个不同的方向。 (ii)速率之比=化学方程式中相应的化学计量数之比。2.定:若反应混合物中各组成成分的物质的量、质量,物质的量浓度或各成分的百分含量(体积分数、质量分数),转化率,等不随时间变化而变化。间接判断法3.从反应混合气体的平均相对分子质量M考虑(I)若各物质均为气体 对于非等化学计量数的反应,M一定时可做为达到平衡标志。如: 2SO2(g)+O2(g) 2SO3(g) 对于等化学计量数反应, M一定时不能做为平衡标志。 如 :H2(g)+I2(g) 2HI(g)(II)若有非气体参与,无论等计量数或非等计量数反应,M一定时可做为达到平衡标志。 如:C(s)+O2(g) CO2(g) 、 CO2(g)+C(s) 2CO(g)4.从气体密度考虑(I)当反应前后各成分均为气体时恒容:不变时,不能做为达到平衡的标志。恒压: 等计量数的反应,不变时
2、,不能作为达到平衡的标志。非等计量数的反应,不变时,可做为达到平衡的标志。 (II)当有非气体物质参与时恒容:不变时,可作为达到平衡的标志。恒压:不变时,可作为达到平衡的标志。5. 从体系压强考虑:恒温恒容条,气体的压强与物质的量成正比,所以只需考虑气体物质的量的变化n(g)当n(g)=0,即等计量数的反应则p为恒值,不能作平衡标志。当n(g)0,即非等计量数的反应则当p一定时,可做平衡标志。6.反应体系中有颜色变化,若体系颜色不变,则达到平衡。7.隔热反应体系温度不变,则达到平衡。(注意:对于反应前后气体体积不变的反应(即反应前后化学计量数相等的反应),通常不能用物质的量、容器的压强、气体的密度、平均相对分子质量等是否变化作为判断平衡状态的标志。)化学平衡状态标志的判断专项训练姓名: 班级:1. 在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)2Y(g)2Z(g)此反应达到平衡的标志是:( )A 容器内压强不随时间变化 B 容器内各物质的浓度不随时间变化C 容器内X、Y、Z的浓度之比为122 D单位时间消耗0.1mol X同时生成0.2
3、mol Z2.可逆反应N23H22NH3,下列各关系中能说明反应已达到平衡状态的是:( )A 3v正(N2)v正(H2) B v正(N2)v逆(NH3)C 2v正(H2)3v逆(NH3) D v正(N2)3v逆(H2)3.在一定温度下,可逆反应A(气)+3B(气)2C(气)达到平衡的标志是: ( ) A 气体体积为初始体积的一半 B 单位时间内生成n摩A,同时生成3n摩BC. A、B、C的浓度不再变化 D . A、B、C的分子数之比为1:3:24.在一定条件下,反应2NO+O2 2NO2达到平衡的标志:( )A NO、O2、NO2分子数目比是2:1:2 B反应混合物中各组成物质的浓度相等C混合气体的颜色不再发生变化 D混合气体的平均相对分子质量不变5、在2NO2 N2O4的可逆反应中,下列状态属平衡状态的是( )A V正=V逆0时的状态 B. NO2全部转变成N2O4的状态C NO2=N2O4的状态 D. N2O4不再分解的状态E 混合物中,NO2的百分含量不再改变的状态F NO2的分子数与N2O4分子数的比值为2:1的状态G 体系的颜色不再发生变化的状态6、在恒温恒容下,A(固)2B(气)+3C(气),不能说明达平衡的标志是:( )A. 混合气体的压强不变 D. 混合气体的密度不变 B. 混合气体的总物质的量不变 E. 混合气体的平均相对分子质量不变C. B气体的物质的量不变 F. B的体积分数不变7恒温恒容时可证明可逆反应N2 + 3H22NH3已达到平衡状态的是:( )一个NN形成同时,有3个HH键断裂 N2、H2、NH3 的浓度之比=1:3:2 N2、H2、NH3 的物质的量相等 体系压强不再改变,NH3、N2、H2的体积分数不再改变 密度保持不变,v正(H2)=0.6mol/Lmin,v逆(NH3)=0.4mol/LminA.全部 B.只有 C. D.只有8恒温恒容条件I2 (s)+H2 (g)2HI(g),不能判断反应已达到平衡状态的是( )A. 保持其它条件不变时,体系压强不再改变B. 其它条件不变,混合气体平均式量不再改变C. 保持其它条件不变时,体系温度不变D. 混合气体密度不变参考答案1-8 AB C C CD AEG EF C C
《化学平衡状态的判断方法及练习》由会员桔****分享,可在线阅读,更多相关《化学平衡状态的判断方法及练习》请在金锄头文库上搜索。

2023年创业培训研结范文.doc

生产管理述职报告

2023年公司关于复工后新型冠状病毒感染的肺炎疫情防控工作应急预案.doc
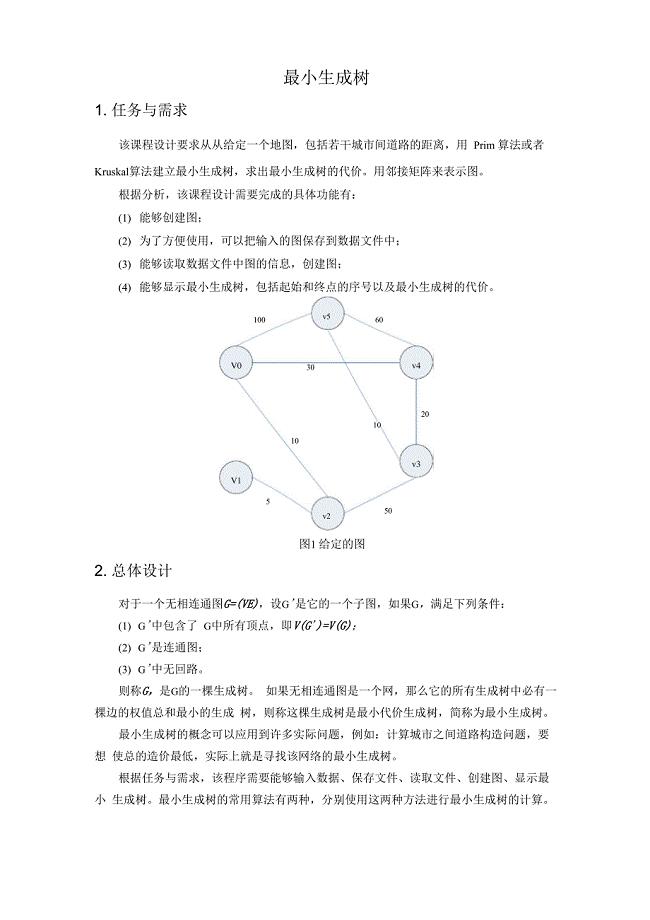
课程设计-最小生成树

2023年小学教师值周工作总结.docx

2023年劳动合同有几种.docx

2023年餐厅销售经理述职报告2.docx

2023年律师事务所实习报告5000字总结范文五篇.docx

2022学年无锡市重点中学毕业升学考试模拟卷英语卷(含答案解析).doc

2023年以人为本构建新时期人口与计划生育新机制2.docx

2023年新闻专业毕业生实习自我鉴定样本.docx

年市委市政府办公室作风建设工作总结

2023年工厂小品抢修在线范文.doc

2023年开学第一课观后感总结(2篇).doc

2023年广播广告文稿类型的小品式.docx

2023年乡镇人口与计划生育工作总结2.docx

房产委托协议书(2篇).doc

2023年村组河塘清淤整治工作汇报新编.docx

2023年大学生下乡工作自我鉴定.docx

谁不说俺家乡好.doc
 八年级下英语第一单元Unit1SectionB教学设计
八年级下英语第一单元Unit1SectionB教学设计
2022-10-23 5页
 《金木水火土》习题
《金木水火土》习题
2022-09-02 3页
 消防安全的高中生倡议书
消防安全的高中生倡议书
2023-09-16 8页
 英语高考必备单词
英语高考必备单词
2023-11-25 8页
 中考必背的30篇英语作文之一
中考必背的30篇英语作文之一
2022-07-30 4页
 2013年六年级下学期数学检测卷(全册)
2013年六年级下学期数学检测卷(全册)
2023-11-27 2页
 安徽省2019年中考道德与法治总复习七上第四单元生命的思考练习
安徽省2019年中考道德与法治总复习七上第四单元生命的思考练习
2022-12-26 6页
 关于亲情话题的作文450字
关于亲情话题的作文450字
2023-03-25 4页
 胆胰疾病内镜诊治中棘手问题析因和应对措施
胆胰疾病内镜诊治中棘手问题析因和应对措施
2022-09-13 10页
 九年级数学上册2014年期末试题(含答案)
九年级数学上册2014年期末试题(含答案)
2022-09-28 7页

