
广东省雷州市高三化学一轮复习水溶液中离子反应专题3.1-2弱电解质的电离
10页1、专题3-1弱电解质的电离【考纲要求】 1.能够准确判别电解质、强电解质和弱电解质。 2.能够准确书写电离方程式。 3.掌握弱电解质在水溶液中的电离平衡。【教学过程】【自主学习】 一强、弱电解质 1.强弱电解质和物质分类的关系 (1)概念2.写出下列电解质的电离方程式 (1)HF_ (2)H2SO3_ (3)Ba(OH)2_ (4)Fe(OH)3_ (5)NaHCO3 (6)NaHSO4 3. 电解质溶液的导电能力强弱决定因素是 二弱电解质的电离平衡(1)电离平衡的建立在一定条件下(如一定温度下),当弱电解质 的速率和 的速率相等时,电离过程达到了平衡。(2)用v-t图像表示电离平衡的建立过程(3)电离平衡的特征4.电离平衡属于动态平衡,当外界条件改变时,弱电解质的电离平衡会发生移动,平衡移动遵循勒夏特列原理。填写下表的空白,归纳外界条件改变对电离平衡的影响。实例(稀溶液)CH3COOH HCH3COOH0改变条件平衡移动方向n(H)c(H)导电能力加水稀释加入少量冰醋酸通入HCl(g)加入NaOH(s)加入镁粉升高温度【学情检测】1.下列说法不正确的是 HClO是弱酸,所以NaClO是
2、弱电解质 弱电解质溶液中存在溶质分子,而强电解质溶液中不存在溶质分子 AgCl的水溶液不导电,而CH3COOH的水溶液能导电,故AgCl是弱电解质,CH3COOH是强电解质 强电解质在溶液中完全电离,不存在电离平衡 导电能力强的溶液其溶质是强电解质 强电解质在液态时,有的导电,有的不导电2.将下列物质进行分类: BaSO4 Ca(OH)2 HI HF Fe(OH)3 Al(OH)3 SO2 Cu HClO Cl2 (11)NH3H2O (12)盐酸 (13)CaO 属于强电解质的_ 属于弱电解质的_3在醋酸溶液中,CH3COOH的电离达到平衡的标志是() A溶液显电中性 B溶液中无CH3COOH分子 C氢离子浓度恒定不变 Dc(H)c(CH3COO)4.下列关于一定温度、一定浓度的氨水的说法正确的是()ANH3H2O的电离达到平衡的标志是溶液呈电中性B是个常数C氨水促进了水的电离Dc(NH)c(H)c(NH3H2O)c(OH)5.对常温下0.1 molL1的醋酸溶液,以下说法正确的是()A由水电离出来的c(H)1.01013molL1Bc(CH3COOH)c(H)c(CH3COO)c(
3、OH)C与同浓度的盐酸分别加水稀释10倍:pH(醋酸)pH(盐酸)D与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)c(CH3COO)0.1 molL16H2S水溶液中存在电离平衡H2SHHS和HSHS2。若向H2S溶液中() A加水,平衡向右移动,溶液中氢离子浓度增大 B通入过量SO2气体,平衡向左移动,溶液pH增大 C滴加新制氯水,平衡向左移动,溶液pH减小 D加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小7.分别画出冰醋酸和0.1 molL1醋酸溶液加水稀释时溶液导电能力的变化图。【重点突破】一强弱电解质的比较及图像分析例1.下列关于盐酸与醋酸两种稀溶液的说法正确的是() A相同浓度的两溶液中c(H)相同 B100 mL 0.1 molL1的两溶液能中和等物质的量的氢氧化钠 CpH3的两溶液稀释100倍,pH都为5 D两溶液中分别加入少量对应的钠盐,c(H)均明显减小例题2.25 时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是() A同浓度的NaA与NaB溶液中,c(A)小于c(B) Ba点
《广东省雷州市高三化学一轮复习水溶液中离子反应专题3.1-2弱电解质的电离》由会员pu****.1分享,可在线阅读,更多相关《广东省雷州市高三化学一轮复习水溶液中离子反应专题3.1-2弱电解质的电离》请在金锄头文库上搜索。

肌筋膜疼痛详解

黄土高原窑洞与黄土文化

未来职业生涯规划【五篇】

幼师实习自我鉴定10篇

2023年电子工艺实习心得体会与收获

《谁动了我的奶酪》读后感_40

新人教版一年级数学下册复习知识要点1

一年级新学期语文教学计划例文(三篇).doc

社团元旦活动策划书

土地租赁合同书样本

2023年幼儿园财务工作总结(3篇).doc

语文教师兼班主任工作总结范文

冬季施工燃油加热器安全作业指导书实用版

阳泉关于成立智能终端芯片公司可行性报告_模板
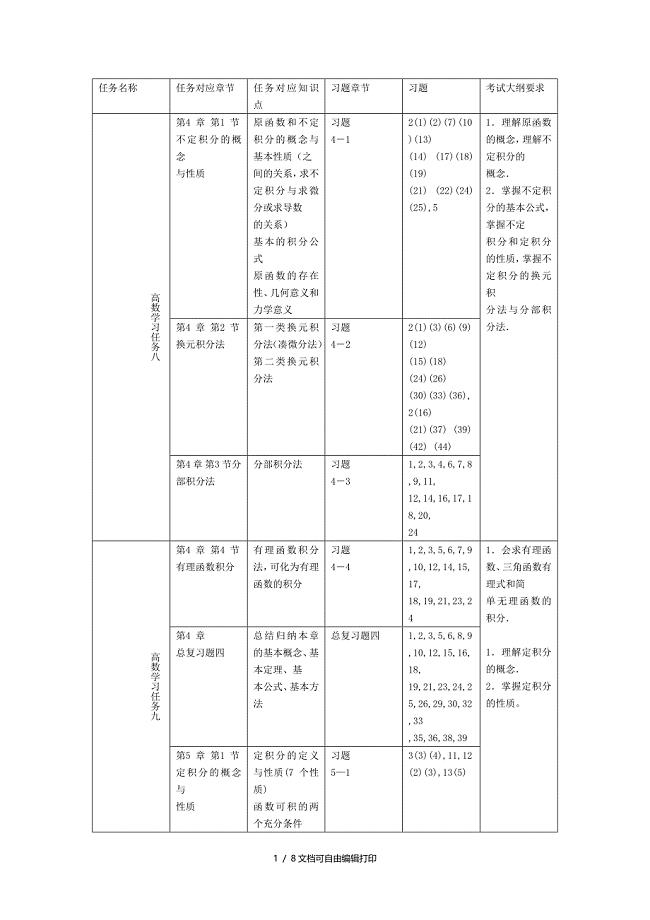
数学一学习任务表

QTZ80塔吊基础施工方案报告

资深教师年度考核个人总结范文(2篇).doc

简短的上半年个人工作总结标准范文(二篇).doc

2022年开学第一课观后感【多篇汇编】

小学音乐教师工作计划5模板
 二泉映月教学设计及反思
二泉映月教学设计及反思
2023-07-07 3页
 任务书与评价表
任务书与评价表
2023-08-31 4页
 三陂幼儿园后勤工作计划
三陂幼儿园后勤工作计划
2022-12-09 7页
 综合管廊水电安装工程施工组织设计.doc
综合管廊水电安装工程施工组织设计.doc
2024-01-17 194页
 用字母表示数教学设计
用字母表示数教学设计
2023-08-16 4页
 七年级生物上册3.6.1食物链同步练习2新版苏科版
七年级生物上册3.6.1食物链同步练习2新版苏科版
2024-01-28 3页
 夺分王基础篇中考语文字音练习
夺分王基础篇中考语文字音练习
2023-10-28 3页
 彭州市丽春镇北君平初级中学事业单位岗位说明书(仅供参考)
彭州市丽春镇北君平初级中学事业单位岗位说明书(仅供参考)
2024-01-19 15页
 八年级数学上册压轴题训练
八年级数学上册压轴题训练
2023-03-02 15页
 初中语文小小说红尘异事红灯记
初中语文小小说红尘异事红灯记
2022-12-12 2页

