
《第二章 化学物质及其变化》复习总结及检测
58页1、章末复习总结提升,第二章,化学物质及其变化,一物质的分类(首先确定分类标准,然后对所选物质进行分类),物质,纯净物,单质,金属 NaMgAl,非金属 SO2N2,本章知识体系展现,化合物,按组成分,氧化物,酸性氧化物 SO2SO3P2O5,碱性氧化物 Na2OCaOFe2O3,两性氧化物 Al2O3,不成盐氧化物 CONO,酸,按酸根分,含氧酸 HNO3H2SO4,无氧酸 HCl,按电离出 的H+数分,一元酸 HClHNO3,二元酸 H2SO4H2SO3,多元酸 H3PO4,碱,按强弱分,强碱 NaOHBa(OH)2,弱碱 NH3H2OFe(OH)3,按电离出的 OH-数分,一元碱 NaOH,二元碱 Ba(OH)2,多元碱 Fe(OH)3,盐,正盐 Na2CO3,酸式盐 NaHCO3,碱式盐 Cu2(OH)2CO3,按性质分,电解质,溶于水或熔融状态下能自身电离出自由移动的离子的化合 物酸碱盐是电解质,非电解质,混合物,普通混合物,分散系,溶液分散质粒子直径小于1 nm,可以透过滤纸和半透膜,胶体分散质粒子直径在1100 nm之间,具有介稳性丁达尔效应聚沉电泳,不能透过半透膜,能透过滤
2、纸,浊液分散质粒子直径大于100 nm,不能透过滤纸和半透膜,二化学反应,根据反应物 和生成物的 类别以及反 应前后物质 种类的多少,化合反应:A+B=AB(部分为氧化还原反应),分解反应:AB=A+B(部分为氧化还原反应),置换反应:A+BC=AC+B(全为氧化还原反应),复分解反应:AB+CD=AD+CB(全为非氧化还原反应),根据反应中是否有 离子参加 (离子反应),定义:有离子参加的一类反应,主要包括复分解反应有离子参 加的置换反应,离子方程式,定义:用实际参加反应的离子符号来表示化学反应的式子,书写 方法,写:写出反应的化学方程式,拆:把易溶于水易电离的物质拆写成离子形式,删:将不参加反应的离子从化学方程式 两端删去,查:查化学方程式两端原子个数和电荷数是否相等,意义:不仅表示了某一个化学反应,而且表示了某一类型的所有化学反应,正误判断:五“看” 书写原则,实质:向着某种离子浓度减小的方向进行,类型,离子非氧化还原反应,离子互换反应(生成气体沉淀或弱电解质),碱性氧化物与酸反应,酸性氧化物与碱反应,离子氧化 还原反应,置换反应(金属单质或非金属单质的相对活动性),一般离子氧化
3、还原反应(生成氧化性或还原性更弱的物质),根据反应中是否有电子转移,氧化还原反应,实质:有电子转移(得失或偏移),特征:反应前后元素的化合价有变化,概念及其相互关系,反应物,氧化剂,(有氧化性)得电子,化合价(降低),发生(还原)反应,(还原)产物,同时存在,同时体现,数目相等,同时发生,同时产生,还原剂,(有还原性)失电子,化合价(升高),发生(氧化)反应,(氧化)产物,生成物,电子转移 表示方法,双线桥法:,失去2e-,得到2e-,单线桥法:,2e-,非氧化还原反应,专题一 离子方程式的正误判断及设错方式 纵观近几年高考试题,离子方程式的正误判断题型的再现率达100%,而且这类试题的失分率居高不下,但所考查的知识并不是无边无际现对这类试题进行归类分析总结如下: 设错方式1:不符合客观事实,错写反应产物 如2Fe3+3S2-=Fe2S3,Fe3+有氧化性,S2-有还原性,Fe3+可将S2-氧化为S,即应写成2Fe3+S2-=2Fe2+S,专 题 探 究,设错方式2:漏写部分离子反应 如Ba(OH)2溶液与H2SO4溶液反应:Ba2+SO2-4=BaSO4, 同学们只注意了Ba2+与S
4、O2-4的反应,而漏掉了H+与OH-的反应 设错方式3:错写反应物或产物的配比关系 如Ba(OH)2溶液与H2SO4溶液反应:Ba2+OH-+H+SO2- 4=BaSO4+H2O,应写成Ba2+2OH-+2H+SO2- 4=BaSO4+2H2O,设错方式4:电荷不守恒或原子不守恒 如Fe2+Cl2=Fe3+2Cl-,应写成2Fe2+Cl2=2Fe3+2Cl- 设错方式5:氧化还原反应中得失电子不守恒 如2MnO-4+3H2O2+6H+=2Mn2+4O2+6H2O,应写成 2MnO-4+5H2O2+6H+=2Mn2+5O2+8H2O 设错方式6:忽视了题设条件及要求 如“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序等对反应方程式或产物的影响,与量有关的离子方程式的书写,其关键是明确反应原理,量不同,离子方程式不同,以少(不足量的物质)定多(过量的物质),量少的定为1 mol,量 多的物质根据1 mol量少物质的反应用量来确定,即“以少定多”原则 如:NaHCO3溶液和Ca(OH)2溶液混合,当Ca(OH)2不足时,Ca2+OH-应完全反应,离子方程式:2HCO-3+Ca2+
《《第二章 化学物质及其变化》复习总结及检测》由会员hu****a8分享,可在线阅读,更多相关《《第二章 化学物质及其变化》复习总结及检测》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
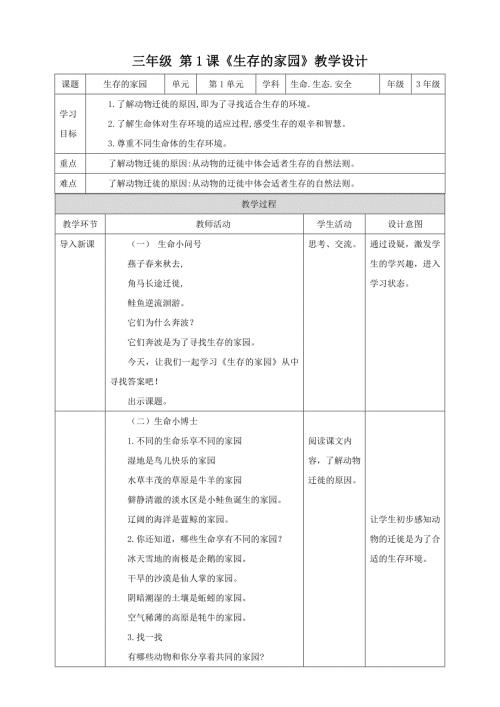
第1课《生存的家园》教学设计
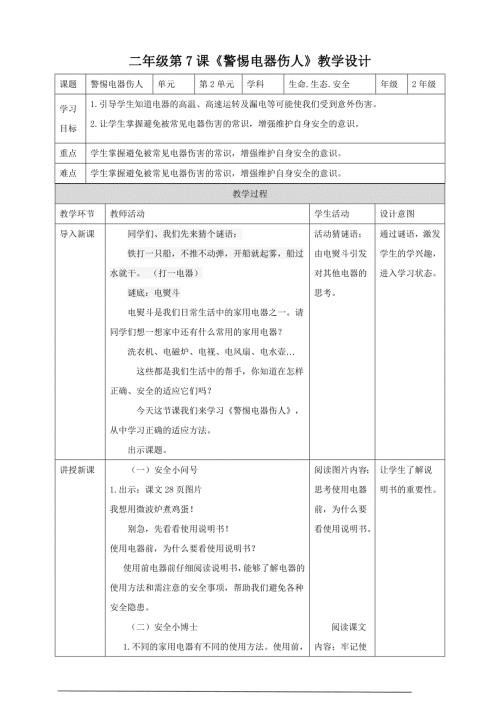
第7课《警惕电器伤人》教学设计
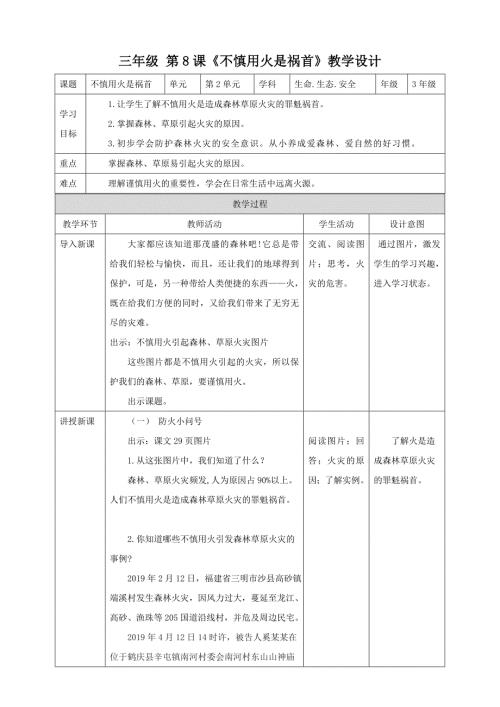
第8课《不慎用火是祸首》教学设计
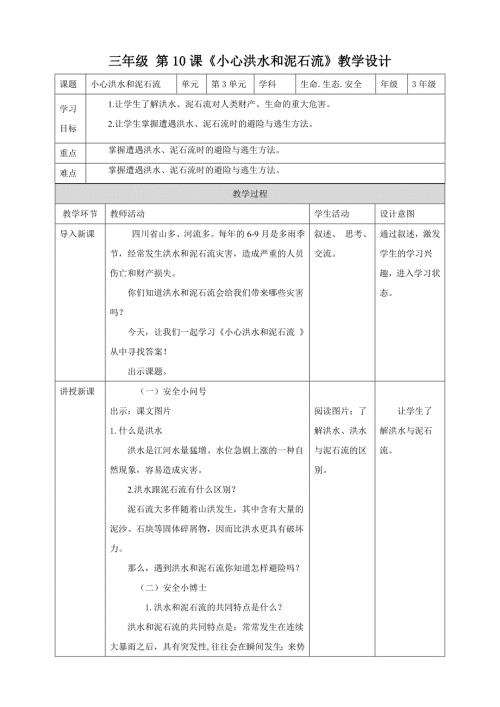
第10课《小心洪水和泥石流》教学设计
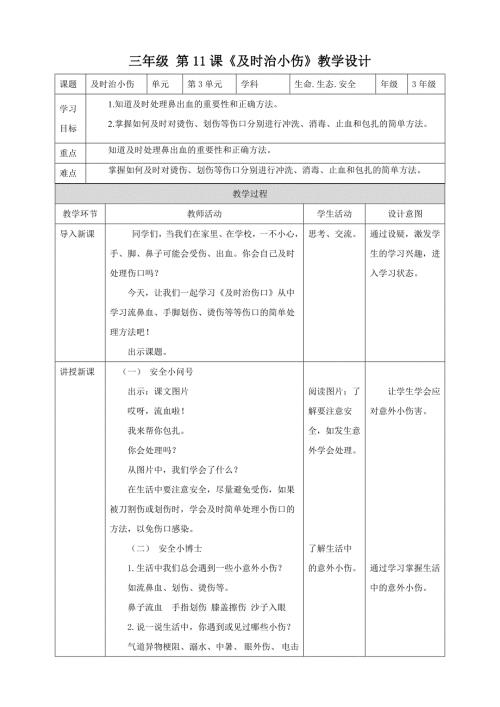
第11课《及时治小伤》教学设计
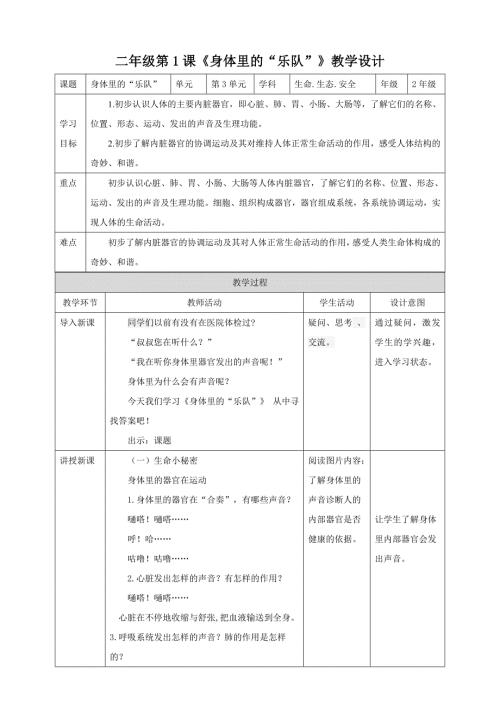
第1课《身体里的“乐队”》教案
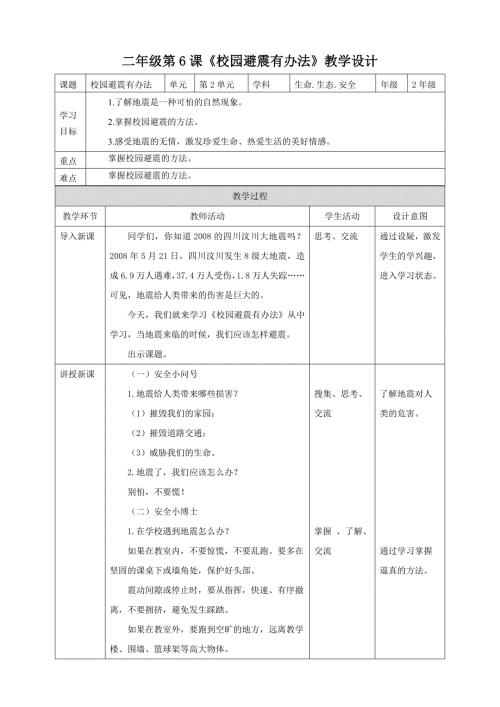
第6课《校园避震有办法》教学设计
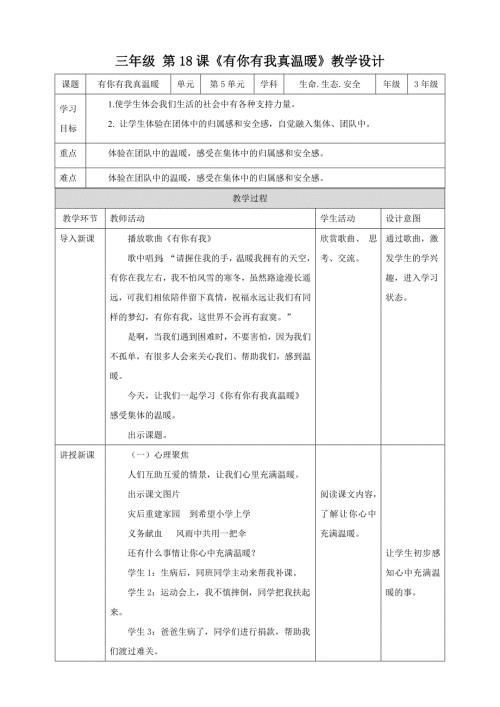
第18课《有你有我真温暖》教学设计
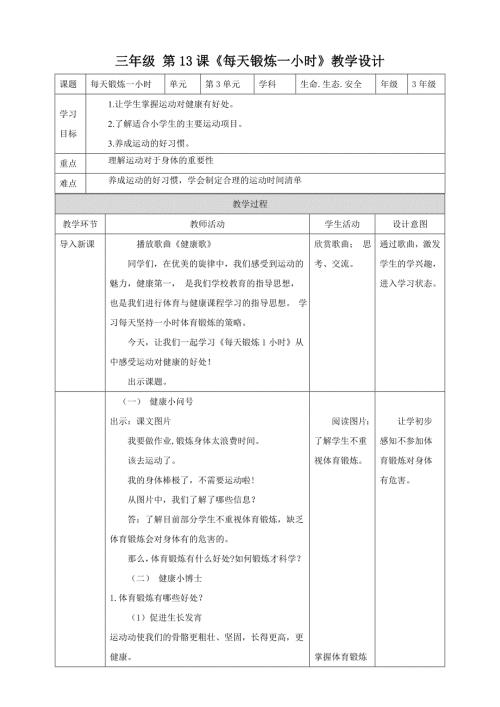
第13课《每天锻炼一小时》教学设计
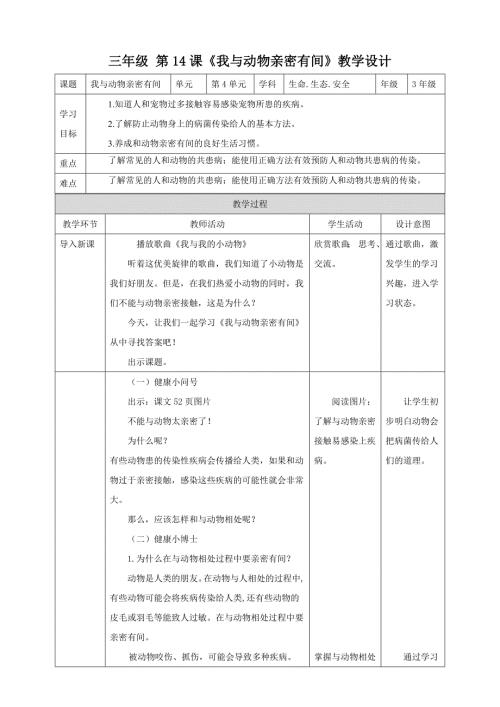
第14课《我与动物亲密有间》教学设计
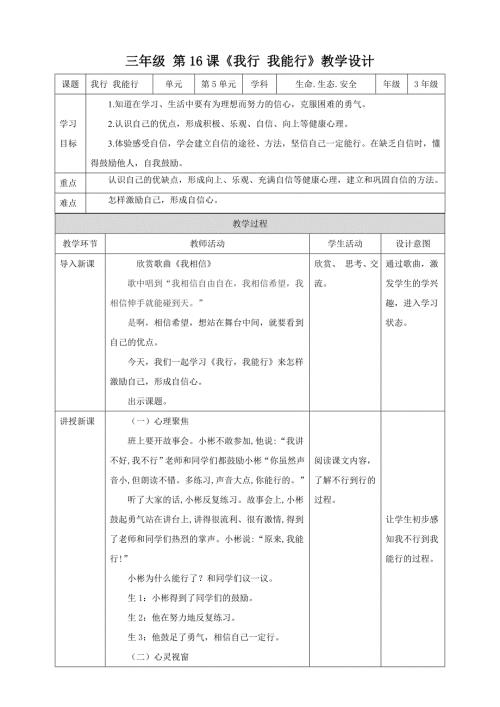
第16课《我行我能行》教学设计
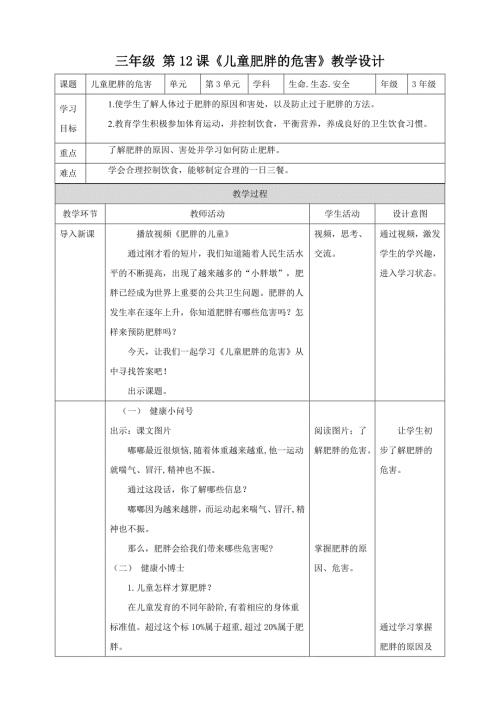
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页

