
《物质的量浓度》课件(2019)
73页1、第3课时 物质的量浓度,一物质的量浓度 1.用来表示单位体积溶液里所含溶质B的物质的量的物理量,叫做溶质B的物质的量浓度符号cB,单位为mol/L(或molL-1)公式为:cB=fracn_BV 2.在稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液中溶质的物质的量相等,可表示为c(浓硫酸)V(浓溶液)=c(稀溶液)V(稀溶液),课前自主学习,二一定物质的量浓度溶液的配制 配制100 mL 2.00 mol/L的NaCl溶液 1.主要仪器:托盘天平100 mL容量瓶烧杯玻璃棒胶头滴管药匙等 2.配制步骤 (1)计算:根据nB=cBV可知n(NaCl)=0.2 mol,则m(NaCl)=11.7g (2)称量:根据计算结果用托盘天平称量所需NaCl (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解,用玻璃棒不断搅拌,并冷却至室温,(4)转移:将烧杯中的溶液用玻璃棒引流转移到 100 mL容量瓶中 (5)洗涤:用少量蒸馏水洗涤烧杯内壁23次,洗涤液也都注入容量瓶中轻轻晃动容量瓶使溶液混合均匀 (6)定容:将蒸馏水注入容量瓶,液面离容量瓶颈刻
2、度线下12 cm时,改用胶头滴管滴加蒸馏水至与液面刻度线相切 (7)摇匀:盖好瓶塞,反复上下颠倒,摇匀 (8)装瓶:把配好的溶液倒入预备好的试剂瓶中,贴上标签,诱思探究:在配制NaCl溶液时,如果不用蒸馏水洗涤烧杯,对NaCl的物质的量浓度有何影响? 提示:烧杯内壁残留有少量NaCl,如果不用蒸馏水,洗涤烧杯23次,会使所配溶液浓度偏低,一容量瓶使用的注意事项 1.容量瓶的标注内容 (1)容量瓶上标有温度容积刻度线 (2)表示在所指温度下,液面与刻度线相切时,溶液体积恰好与瓶上标注的体积相等,所以只有在指定温度下,容量瓶的容积才是标准的 (3)常用规格有100 mL250 mL500 mL及1 000 mL,课堂深化探究,2.容量瓶使用注意事项 (1)容量瓶瓶口配有磨口玻璃塞或塑料塞使用前,除洗涤外,还应检查容量瓶是否完好,检验容量瓶是否漏液检漏方法: 往瓶内加入一定量水,塞好瓶塞用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立起来,观察瓶塞周围是否有水漏出如果不漏水,将瓶正立并将瓶塞旋转180后塞紧,仍把瓶倒立起来,再检查是否漏水 (2)只用于配制溶液,不能直接在容量瓶中溶解或稀释,容量瓶
3、也不能作为反应容器,且不能长期贮存溶液,(3)向容量瓶中注入液体时,应沿细玻璃棒注入,且玻璃棒下端应靠在容量瓶刻度线以下的内壁上,以防注入操作时液体流出,造成溶质损失 (4)溶液注入容量瓶前需恢复到常温,因为溶质在烧杯内稀释或溶解时会吸热或放热,而容量瓶必须在常温下使用 (5)用容量瓶不能配制任意体积的一定物质的量浓度的溶液,这是因为容量瓶的规格是固定的,配制溶液时要根据所需溶液的体积选择合适的容量瓶 (6)读数时,要使视线与瓶内凹液面的最低处相切,二配制一定物质的量浓度溶液的误差分析 由 可知,误差来源的根本原因是:物质的量或溶液体积产生的误差,若n偏大或V偏小,则c偏大;若n偏小或V偏大,则c偏小 常见的误差分析如下:,(1)若称量物错放在托盘天平右盘上,则m变小使c偏小,因称量时m(左)=m(右)+m(游码) (2)若称量固体溶质时,操作无误,但所用的砝码生锈,则m偏大,c偏高 (3)若没有洗涤溶解用的烧杯及玻璃棒,则n偏小,c偏小 (4)转移过程中有少量溶液或洗涤液洒在容量瓶外,则n偏小而使c偏小 (5)转移溶液未冷却至室温,因液体的膨胀系数大于玻璃的膨胀系数,冷却后液面必低于
4、刻度线,则c偏高,(6)容量瓶使用前含有少量蒸馏水,则无影响 (7)定容时水加多了,用滴管吸出,则n变小而使c偏小 (8)定容后,经振荡摇匀静置,液面下降少许是正常的,不必再加水至刻度线,若再加水,则V变大而使c偏小 (9)定容时仰视刻度线,由于操作以刻度线为基准加水,故加水量增多,导致V偏大,c偏小 (10)定容时俯视刻度线,则加水量减少,导致V变小,故c偏高,三物质的量浓度的有关计算 1.已知一定体积的溶液中溶质的量,求溶质的物质的量浓度 (1)若已知溶质质量 (2)若已知溶质中某粒子的个数,2.求算一定体积的气体(标准状况)溶于水后形成溶液中溶质的物质的量浓度 (1)若已知溶液的体积,2)若已知溶液的密度 如果气体的摩尔质量为M gmol-1,V L(标准状况)该气体溶于1 L水中所得溶液的密度为 gcm-3 先计算溶质的物质的量 再计算溶液的体积,最后计算物质的量浓度,3.已知溶液中某种粒子的物质的量浓度,求其他粒子的物质的量浓度 解答此类题目时要依据两个规律: (1)定组成规律 电解质溶液中,阴离子与阳离子浓度之比等于化学组成中离子个数之比,据此可求已知一种离子浓度的溶液中的
《《物质的量浓度》课件(2019)》由会员hu****a8分享,可在线阅读,更多相关《《物质的量浓度》课件(2019)》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
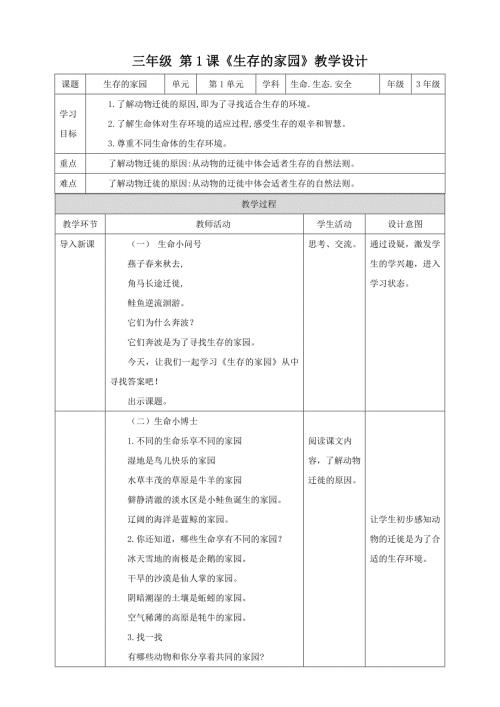
第1课《生存的家园》教学设计
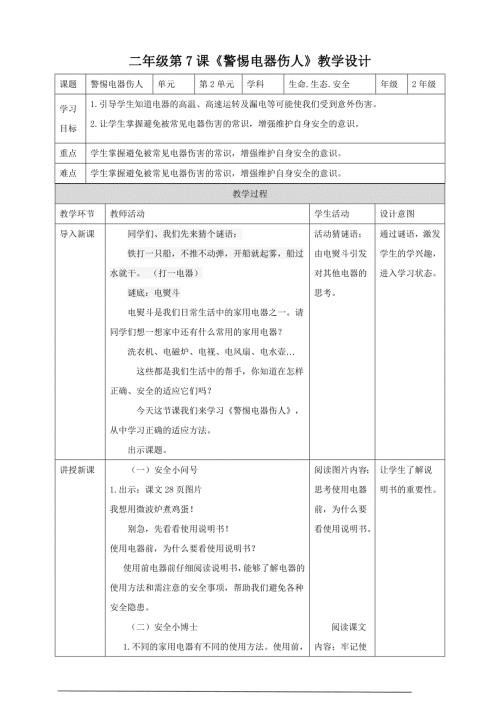
第7课《警惕电器伤人》教学设计
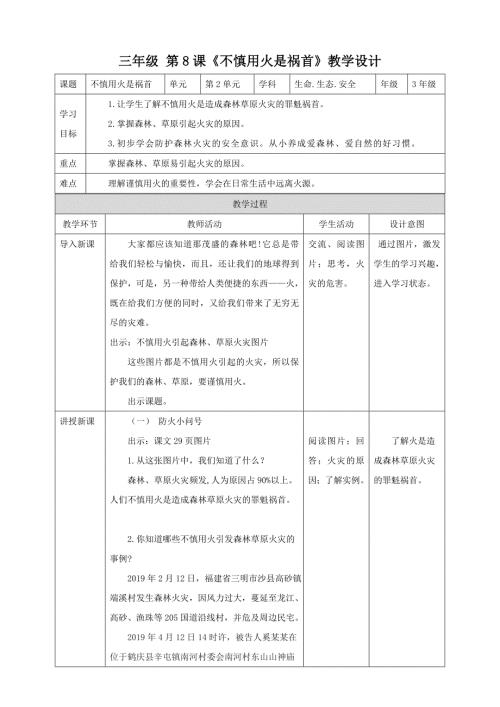
第8课《不慎用火是祸首》教学设计
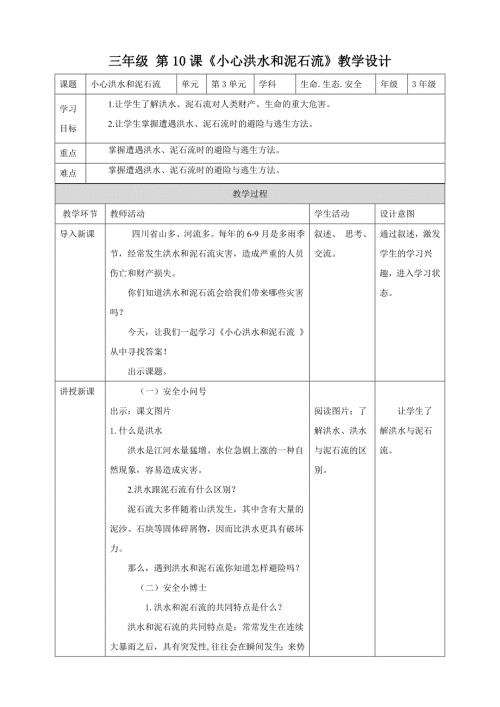
第10课《小心洪水和泥石流》教学设计
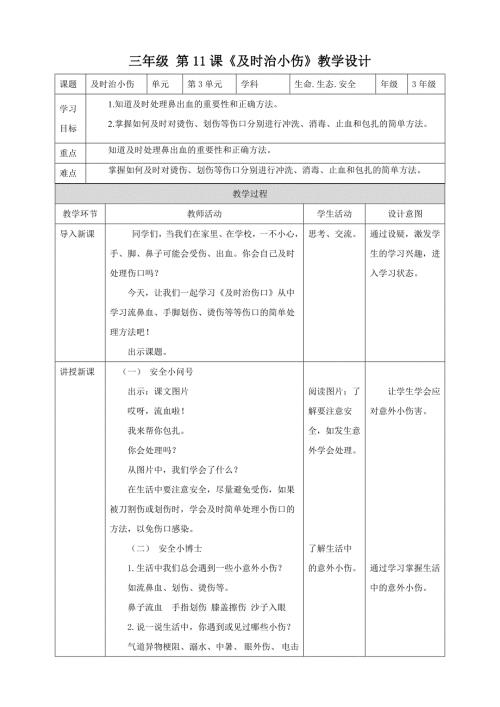
第11课《及时治小伤》教学设计
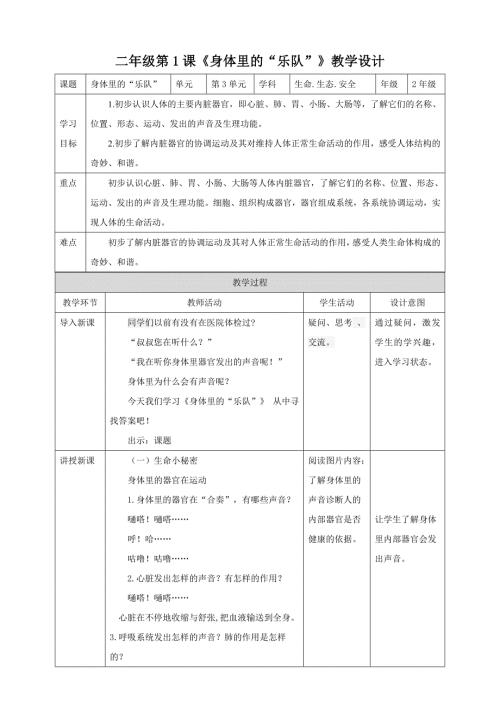
第1课《身体里的“乐队”》教案
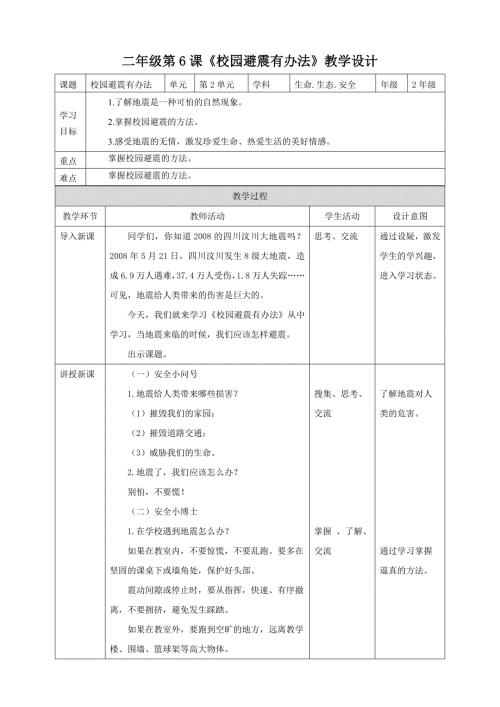
第6课《校园避震有办法》教学设计
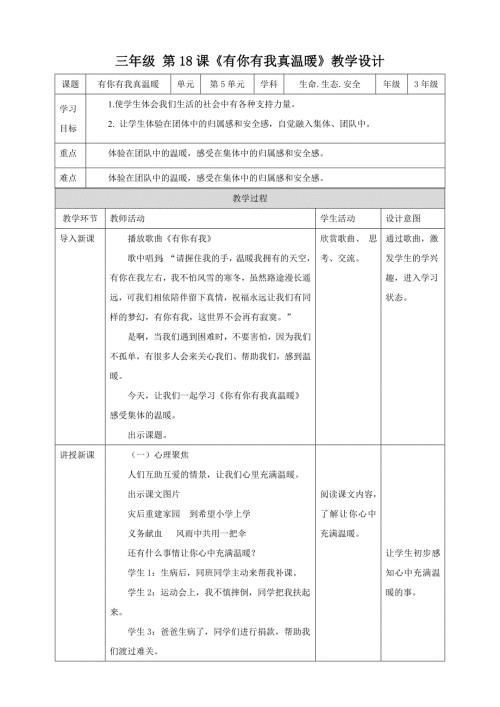
第18课《有你有我真温暖》教学设计
第13课《每天锻炼一小时》教学设计
第14课《我与动物亲密有间》教学设计
第16课《我行我能行》教学设计
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页

