
高考.化学工艺规范流程题
41页1、工艺流程题专题(教师版)考察形式:流程图、表格图像、文字叙述 问题类型:措施、成分、物质、原因能力考查:获取信息的能力、分解问题的能力、表达能力 知识基础:基本生产理论,金属、非金属及其化合物、有机物的性质,实验基本操作无机工业流程图题能够以真实的工业生产过程为背景,体现能力立意的命题指导思想,能够综合考查各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力。【例】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下: 分离提纯预处理分离提纯 还原原 料:矿石(固体)预处理:酸溶解(表述:“浸出”)除 杂:控制溶液酸碱性使金属离子形成沉淀核心化学反应是:控制条件,调节PH,使Mg2+全部沉淀解题技巧:明确整个流程及每一部分的目的 仔细分析每步发生的反应及得到的产物 结合基础理论与实际问题思考 注意答题的模式与要点 在解这类题目时:1、要粗读试题,尽量弄懂流程图,但不必将每一种物质都推出。2、再精读试题,根据问题去精心研究某一步或某一种物质。3、要看清所问题,不能答非所问,并注意语言表达的
2、科学性在答题时应注意:前一问回答不了,并不一定会影响回答后面的问题。一、分析流程图需要掌握的技巧是:浏览全题,确定该流程的目的由何原料获得何产物(副产物),对比原料和产物;了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;解析流程图并思考:从原料到产品依次进行了什么反应?利用了什么原理(氧化还原?溶解度?溶液中的平衡?)。每一步操作进行到什么程度最佳?每一步除目标物质外还产生了什么杂质或副产物?杂质或副产物是怎样除去的?二、无机化工题:要学会看生产流程图,对于比较陌生且复杂的流程图,宏观把握整个流程,不必要把每个环节的原理都搞清楚,针对问题分析细节。1.考察内容主要有:(1)原料预处理(2)反应条件的控制(温度、压强、催化剂、原料配比、PH调节、溶剂选择)(3)反应原理(离子反应、氧化还原反应、化学平衡、电离平衡、溶解平衡、水解原理、物质的分离与提纯)(4)绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)(5)化工安全(防爆、防污染、防中毒)等。2规律考 点主线主产品分支副产品回头为循环知识点物质的分离操作除杂试剂的选
3、择生产条件的控制产品分离提纯3.熟悉工业流程常见的操作与名词原料的预处理溶 解 通常用酸溶。如用硫酸、盐酸、浓硫酸等灼 烧 如从海带中提取碘煅 烧 如煅烧高岭土,改变结构,使一些物质能溶解。并使一些杂质高温下氧化、分解研 磨 适用于有机物的提取,如苹果中维生素C的测定等。4.控制反应条件的方法控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀 - pH值的控制。例如:已知下列物质开始沉淀和沉淀完全时的pH 如下表所示物质开始沉淀沉淀完全Fe(OH)32.73.7Fe(OH)27.69.6Mn(OH)28.39.8问题:若要除去Mn2溶液中含有的Fe2,应该怎样做?调节pH所需的物质一般应满足两点: (1)能与H反应,使溶液pH值增大; (2)不引入新杂质。例如:若要除去Cu2溶液中混有的Fe3,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值 蒸发、反应时的气体氛围加热的目的 加快反应速率或促进平衡向某个方向移动降温反应的目的 防止某物质在高温时会溶解或为使化学平衡向着题目要求的方向移动趁热过滤 防止某物质降温时会析出冰水洗涤 洗去晶体表面的杂质离子,并减少晶
《高考.化学工艺规范流程题》由会员不***分享,可在线阅读,更多相关《高考.化学工艺规范流程题》请在金锄头文库上搜索。
![电力设备预防性试验规章制度[2017年]](https://union.02img.goldhoe.com/2019-11/16/4667be4f-7732-484e-a02e-4246affcb5f8/pic1.jpg)
电力设备预防性试验规章制度[2017年]

电力设备预防性试验规章制度(2016)

电力设备销售技巧大全

电力行业项目工程设计资质分级

电力管线施工专项计划方针
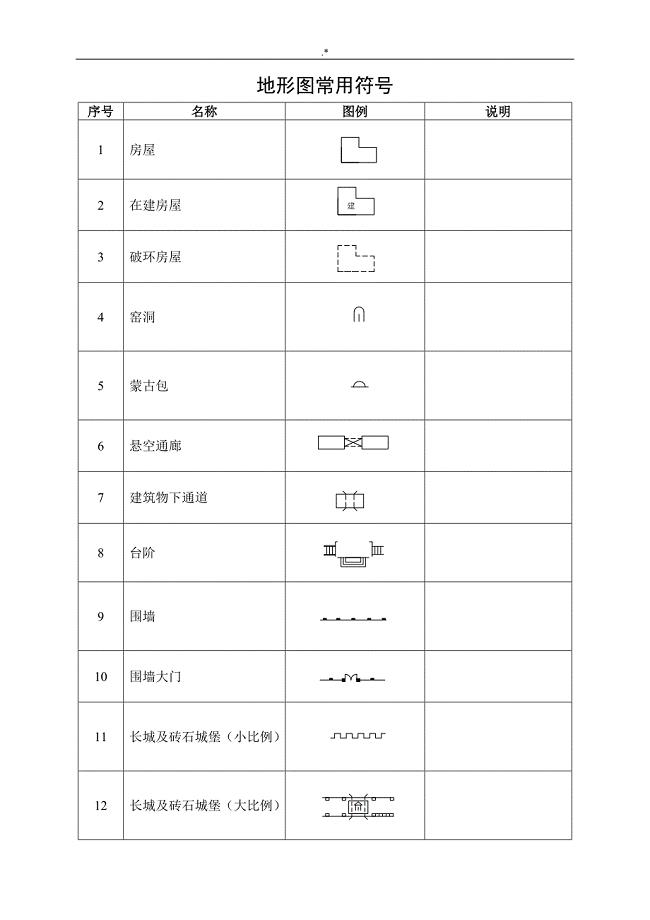
地形图普通符号(整编汇总)

地坪拆除修复施工方案方针

SL223-2008水利水电建设项目工程验收规章制度

RBT214-2017检验检测机构通常要求新编内审检查表

QUIC协议合约介绍

钢材采购招投标材料

风冷模块维护介绍资料

风控介绍资料(定版)

风景园林项目工程试题及其答案解析

电力设备采购合同协议文本范文样式(最佳)

电力设备安装项目工程投标书

电力三级及其以上施工安全风险识别,评估和预控清册

电力浅沟专项施工方案方针

电力设备交接和预防性试验规章制度

2017新课标全国卷3语文试题及其答案解析
 医用高等数学课件4-导数与中值定理练习-答案-(2012)
医用高等数学课件4-导数与中值定理练习-答案-(2012)
2023-02-28 2页
 共产党宣言稿子
共产党宣言稿子
2022-11-14 8页
 社会学概论00034密训资料(最新版)
社会学概论00034密训资料(最新版)
2022-11-08 12页
 马克思主义基本原理概论03709密训资料
马克思主义基本原理概论03709密训资料
2022-11-09 12页
 社会学概论00034考前资料
社会学概论00034考前资料
2022-11-08 16页
 社会学概论00034主观题汇总
社会学概论00034主观题汇总
2022-11-08 17页
 马克思主义基本原理概论03709主观题汇总
马克思主义基本原理概论03709主观题汇总
2022-11-08 15页
 英语(二)必备词汇表-4500单词
英语(二)必备词汇表-4500单词
2022-11-02 39页
 领导科学00320主观题汇总(最新版)
领导科学00320主观题汇总(最新版)
2022-11-02 17页
 行政管理学00277密训资料(最新版)
行政管理学00277密训资料(最新版)
2022-11-02 12页

