
高考化学一轮总复习:第2讲 物质的量浓度
27页1、第2讲 物质的量浓度,高考化学一轮复习,考点突破,考点一 有关物质的量浓度的计算,考点二 配制一定物质的量浓度溶液的误差分析,考点一 有关物质的量浓度的计算,1.物质的量浓度计算的两个关键 (1)正确判断溶液中的溶质并计算其物质的量 与水发生反应生成新的物质,如Na、Na2O、Na2O2 NaOH,SO3 H2SO4等。 含结晶水的物质,如CuSO45H2O CuSO4,Na2SO410H2O Na2SO4。 特殊物质,如NH3溶于水后计算溶质的物质的量时以通入水中的NH3为准。 (2)准确计算溶液的体积,不能用水的体积代替溶液的体积,应根据V= 计算。,2.溶液浓度的计算公式 (1)溶质的质量、溶液的体积和物质的量浓度之间的关系:n= =cV。 (2)物质的量浓度与溶质质量分数的关系 体积为V mL,密度为 gcm-3的溶液,含有摩尔质量为M gmol-1的溶质的 质量分数为,则溶质的物质的量浓度c与溶质的质量分数的关系是:c = = = = = ,= 。 (3)气体溶质溶于水制得的溶液的浓度的计算 标准状况下,1 L水中溶解某气体V L,所得溶液密度为 gcm-3,则c和的 表达式
2、分别是:,c= = = = 100%= 100% = 100% (4)物质的量浓度(c)与溶解度(S)的换算 若某饱和溶液的密度为 gcm-3,溶质的摩尔质量为M gmol-1,溶解度为S g,则物质的量浓度与溶解度的表达式分别为: c= = = , S=,3.溶液稀释定律(守恒观点) (1)溶质的质量在稀释前后保持不变,即m11=m22。 (2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。 (3)溶液质量守恒,m(稀)=m(浓)+m(水)。 4.不同物质的量浓度的同种溶液的混合计算 (1)混合后溶液体积保持不变时,c1V1+c2V2=c混(V1+V2)。 (2)混合后溶液体积发生改变时,c1V1+c2V2=c混V混,其中V混= 。 5.溶质相同、质量分数不同的两溶液混合定律 同一溶质、质量分数分别为a%、b%的两溶液混合。 (1)等体积混合 当溶液密度大于1 gcm-3时,溶液浓度越大,密度越大(如H2SO4、,HNO3、HCl、NaOH等多数溶液)。等体积混合后,质量分数 (a%+b%)。 当溶液密度小于1 gcm-3时,溶液浓度越大,密度越小(如酒精、氨 水)。等体积
3、混合后,质量分数 (a%+b%)。 (2)等质量混合 两溶液等质量混合时,混合后溶液中溶质的质量分数= (a%+b%)。,典例1 在t 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密 度为 gmL-1,质量分数为,其中含有N 的物质的量是b mol,下列叙述 中正确的是 ( ) A.溶质的质量分数= 100% B.溶质的物质的量浓度c= molL-1 C.溶液中c(OH-)= molL-1+c(H+) D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5,C,答案 C A项,溶质的质量分数= 100%;B项,氨水中的溶质在计 算时以NH3为准,将= 100%代入公式c= , 化简可得c= molL-1;C项,氨水中含有的阳离子为H+和N , 含有的阴离子只有OH-,结 合电荷守恒可知溶液中c(OH-)= molL-1+c(H+);D项,由于氨水的密 度小于水的密度,与水等体积混合所得稀氨水的质量大于原氨水质量的 2倍,故其质量分数小于0.5。,1-1 36.5 g HCl溶解在1 L水中(水的密度近似为1 gmL-1),所得溶液的 密度为 gmL-1,质量分数
《高考化学一轮总复习:第2讲 物质的量浓度》由会员hu****a8分享,可在线阅读,更多相关《高考化学一轮总复习:第2讲 物质的量浓度》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
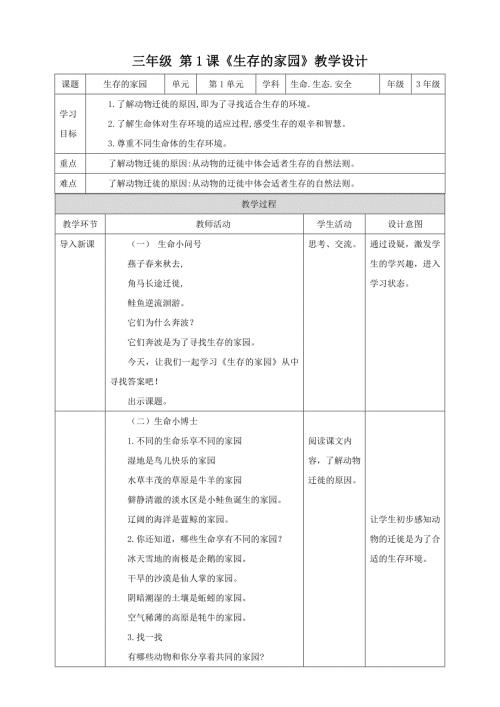
第1课《生存的家园》教学设计
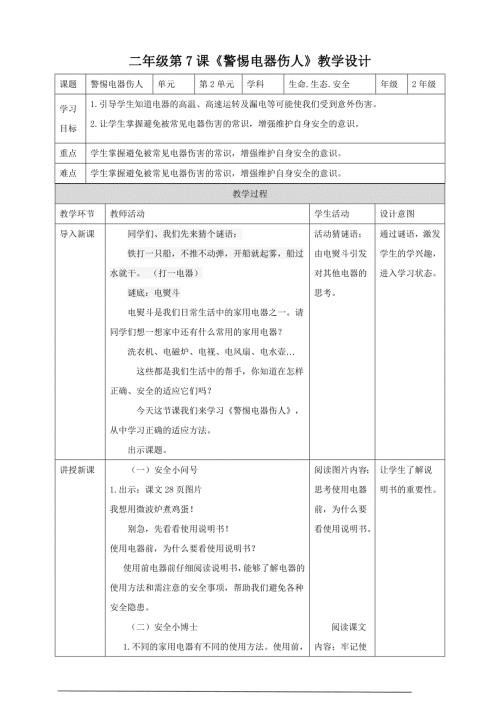
第7课《警惕电器伤人》教学设计
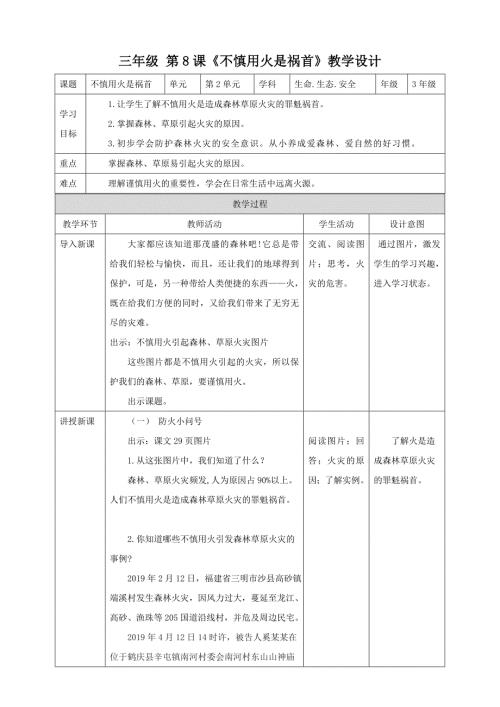
第8课《不慎用火是祸首》教学设计
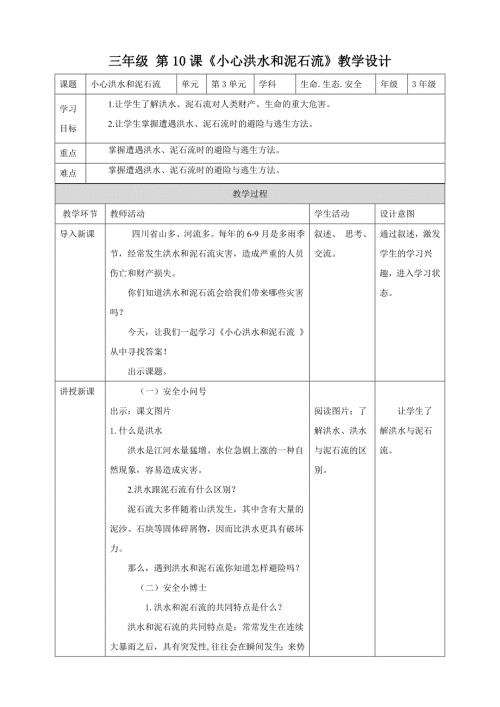
第10课《小心洪水和泥石流》教学设计
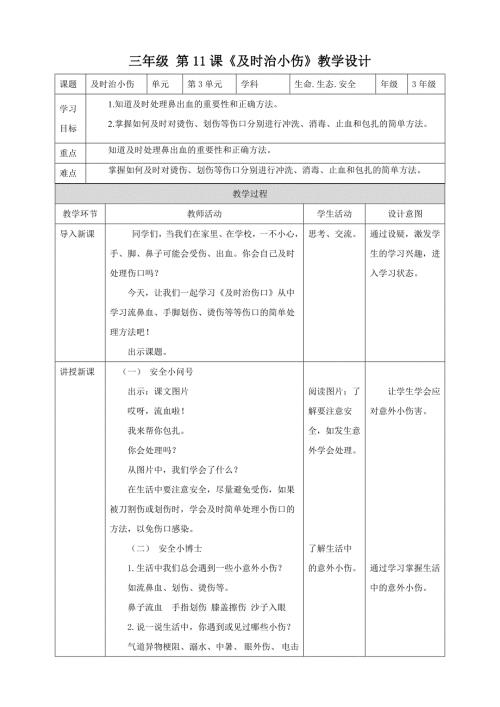
第11课《及时治小伤》教学设计
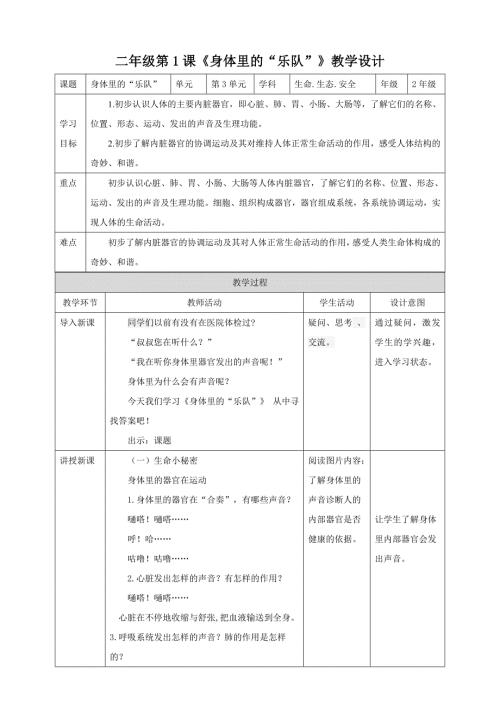
第1课《身体里的“乐队”》教案
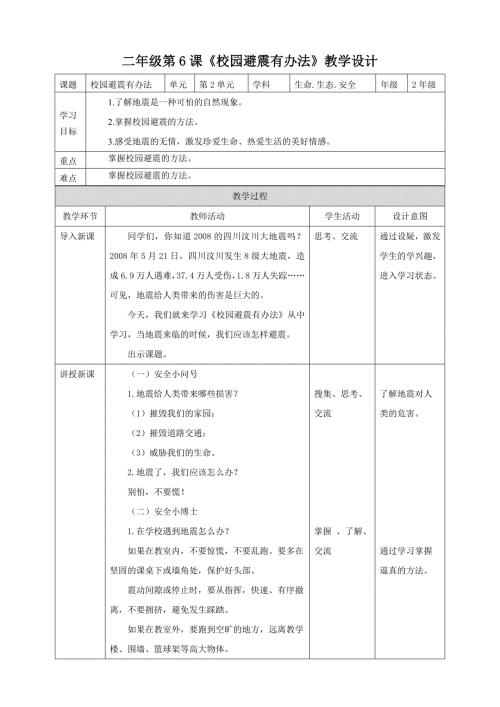
第6课《校园避震有办法》教学设计
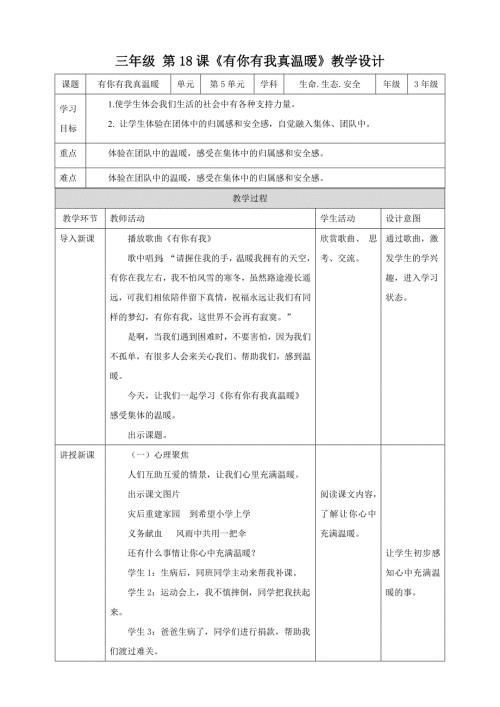
第18课《有你有我真温暖》教学设计
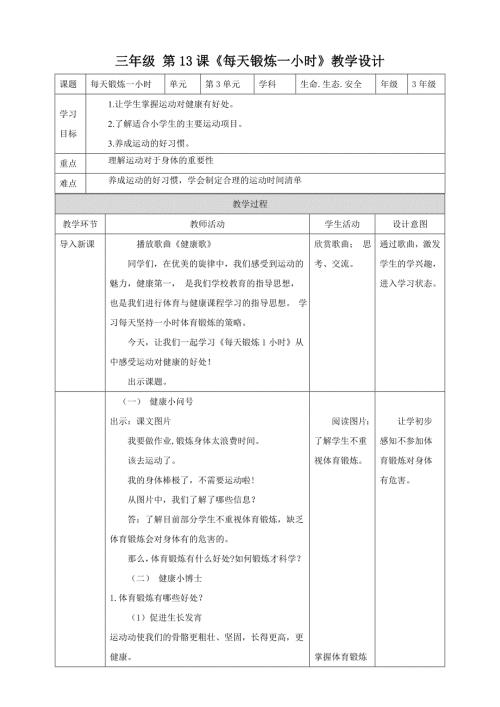
第13课《每天锻炼一小时》教学设计
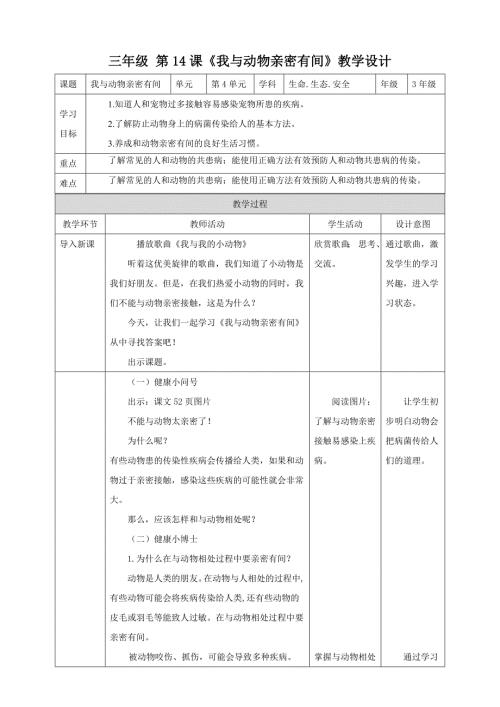
第14课《我与动物亲密有间》教学设计
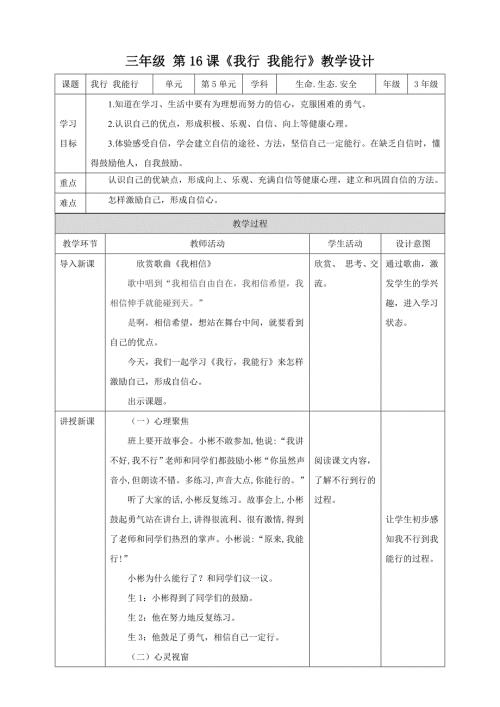
第16课《我行我能行》教学设计
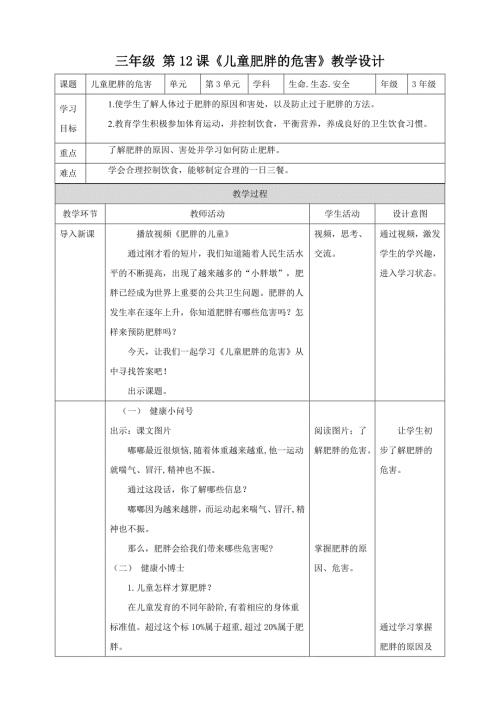
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页
 广东省建筑装饰工程竣工验收技术资料统一用表
广东省建筑装饰工程竣工验收技术资料统一用表 水基防锈剂配方组成比例,防锈原理及配制方法
水基防锈剂配方组成比例,防锈原理及配制方法 辩论赛宁要大城市一张床,宁要小城镇一间房
辩论赛宁要大城市一张床,宁要小城镇一间房 【2018年整理】动力气象吕美仲课后答案.pdf
【2018年整理】动力气象吕美仲课后答案.pdf 红楼梦后28回(癸酉本)
红楼梦后28回(癸酉本) 金锄头网企业认证授权书(负责人非法人必须提供)
金锄头网企业认证授权书(负责人非法人必须提供) 服装设计助理实习周记
服装设计助理实习周记 制造机械项目投资分析报告(总投资15000万元)(78亩)
制造机械项目投资分析报告(总投资15000万元)(78亩) 计算机网络技术基础 教学课件 作者 阚宝朋 课件 第2章 网络体系结构与网络协议
计算机网络技术基础 教学课件 作者 阚宝朋 课件 第2章 网络体系结构与网络协议 计算机网络技术基础 教学课件 作者 阚宝朋 课件 第5章 网络层与网络互联
计算机网络技术基础 教学课件 作者 阚宝朋 课件 第5章 网络层与网络互联 计算机网络技术基础 教学课件 作者 阚宝朋 课件 第1章 网络基础知识
计算机网络技术基础 教学课件 作者 阚宝朋 课件 第1章 网络基础知识 输煤管道生产建设项目可行性研究报告
输煤管道生产建设项目可行性研究报告
