
高考化学一轮总复习:第4讲 离子反应
50页1、第4讲 离子反应,高考化学一轮复习,考点突破,考点一 离子方程式的正误判断,考点三 溶液中离子能否大量共存的判断方法,考点二 离子方程式的书写方法,1.看是否符合客观事实。如Fe和稀盐酸反应的离子方程式写成2Fe+6H + 2Fe3+3H2是错误的,Fe和稀盐酸反应生成Fe2+。 2.看化学式拆写是否正确。这是书写离子方程式时最关键的一步,应注 意以下几点: (1)易溶于水的强电解质均写成离子形式,如强酸、强碱和大多数盐。 其他物质用化学式表示,如单质、氧化物、气体、弱电解质(弱酸、弱 碱、水等)及难溶性盐。 (2)微溶物的写法。一般来说,微溶于水的强电解质的澄清溶液(如澄清 石灰水)中微溶物写成离子形式,浊液中的微溶物写成化学式。 (3)可溶性多元弱酸的酸式酸根一律写成酸式酸根离子的形式(如HC )。,考点一 离子方程式的正误判断,(4)非溶液状态下的反应,一般不用离子方程式表示。如实验室中制备 氨气的反应。 3.看符号使用是否正确。要注意“ ”“ ”“”“”等符 号的正确使用。 4.看是否遵循原子守恒、电荷守恒和得失电子守恒。如Fe3+Cu Fe2 +Cu2+不符合电荷守恒及得失电
2、子守恒,是错误的。 5.看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+ 与S 生成BaSO4沉淀的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2沉淀 的反应。 6.看反应物的组成比例是否正确。如稀硫酸与Ba(OH)2溶液反应,不能,写成H+OH-+S +Ba2+ BaSO4+H2O,应写成2H+2OH-+S +Ba2+ BaSO4+2H2O。 7.看是否符合题设条件的要求。如过量、少量、等物质的量、适量、 任意量以及滴加顺序等对反应产物的影响。如向溴化亚铁溶液中通入 少量Cl2的离子方程式为2Fe2+Cl2 2Fe3+2Cl-;向溴化亚铁溶液中通 入过量Cl2的离子方程式为2Fe2+4Br-+3Cl2 2Fe3+6Cl-+2Br2。,典例1 下列解释事实的方程式中,不正确的是 ( ) A.铜和浓HNO3反应可用于制NO2气体:Cu+4HNO3(浓) Cu(NO3)2+2 NO2+2H2O B.“84”消毒液中滴少量白醋可增强漂白性:ClO-+H+ HClO C.氨水吸收少量SO2防止污染空气:2NH3H2O+SO2 2N +S +H2O D.Na2O2
3、在潜艇中可用于吸收二氧化碳并供氧:2Na2O2+2CO2 2Na2 CO3+O2,B,答案 B B项,醋酸为弱酸,应写化学式。,1-1 下列反应的现象描述与离子方程式都正确的是 ( ) A.金属镁与稀盐酸反应:有氢气产生;Mg+2H+2Cl- MgCl2+H2 B.氯化钡溶液与硫酸反应:有白色沉淀生成;Ba2+S BaSO4 C.碳酸钠溶液与盐酸反应:有气泡逸出;Na2CO3+2H+ 2Na+CO2+H2O D.过量铁粉与氯化铁溶液反应:溶液变为浅绿色;Fe+Fe3+ 2Fe2+,B,答案 B A项,现象应描述为有气体产生,且离子方程式应为Mg+2H+ Mg2+H2;C项,离子方程式应为C +2H+ H2O+CO2;D项, 离子方程式应为Fe+2Fe3+ 3Fe2+。,1-2 下列离子方程式正确的是 ( ) A.用CH3COOH溶解CaCO3:CaCO3+2H+ Ca2+H2O+CO2 B.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3+S +Ba2+3OH- Fe(OH)3+ BaSO4 C.硫酸工业尾气中的SO2用过量的氨水吸收:2NH3H2O+SO2 2N + S +H2O
4、D.Cu溶于浓HNO3:3Cu+8H+2N 3Cu2+2NO+4H2O,C,答案 C A项,CH3COOH是弱电解质,在离子方程式中应写化学式;B 项,离子的计量关系错误,应该是2Fe3+3S +3Ba2+6OH- 2Fe(OH)3 +3BaSO4;C项,SO2用过量的氨水吸收的产物是亚硫酸铵和水;D项, 浓HNO3的还原产物是二氧化氮。,一、离子方程式的书写要点 1.抓住两易、两等、两查 两易:即易溶、易电离的物质(包括强酸、强碱、大多数可溶性盐)以实 际参加反应的离子符号表示,非电解质、弱电解质、难溶物质、气体等 用化学式表示。 两等:离子方程式两边的原子个数、电荷总数均应相等。 两查:检查各项是否都有公约数,是否漏写必要的反应条件。 2.注意的问题 (1)微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学 式。微溶物作为生成物,一般写化学式(标“”号)。如澄清石灰水中,考点二 离子方程式的书写方法,加盐酸的离子方程式为:OH-+H+ H2O。 (2)氨水作为反应物写NH3H2O;作为生成物,若有加热条件或浓度很大 时,可写NH3(标“”号)。 (3)未处于自由移动离子状态
《高考化学一轮总复习:第4讲 离子反应》由会员hu****a8分享,可在线阅读,更多相关《高考化学一轮总复习:第4讲 离子反应》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
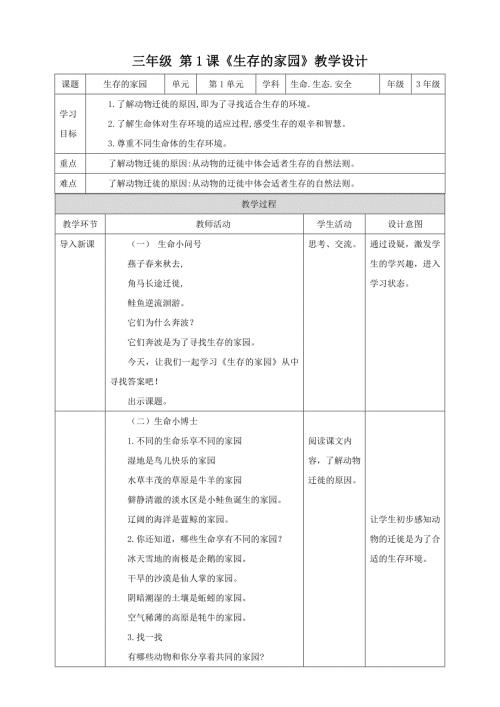
第1课《生存的家园》教学设计
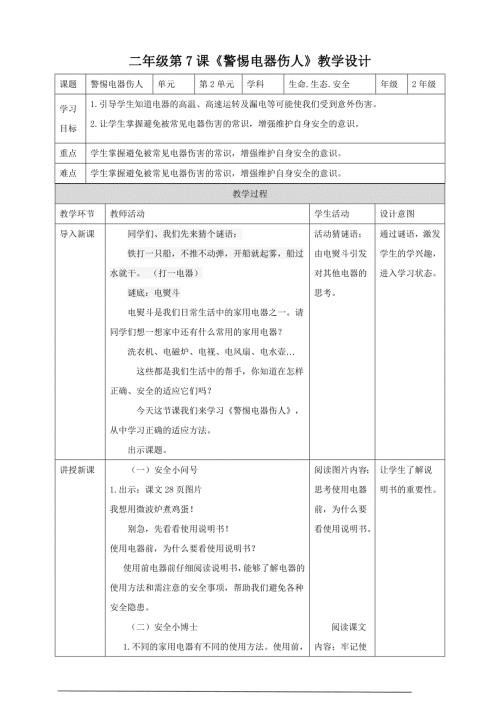
第7课《警惕电器伤人》教学设计
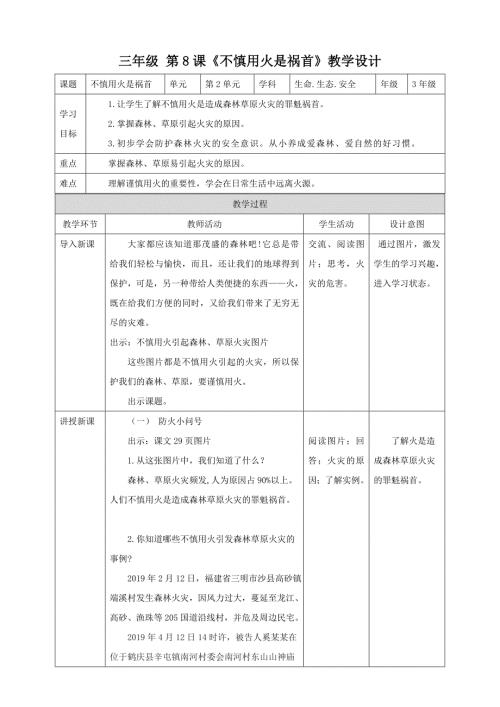
第8课《不慎用火是祸首》教学设计
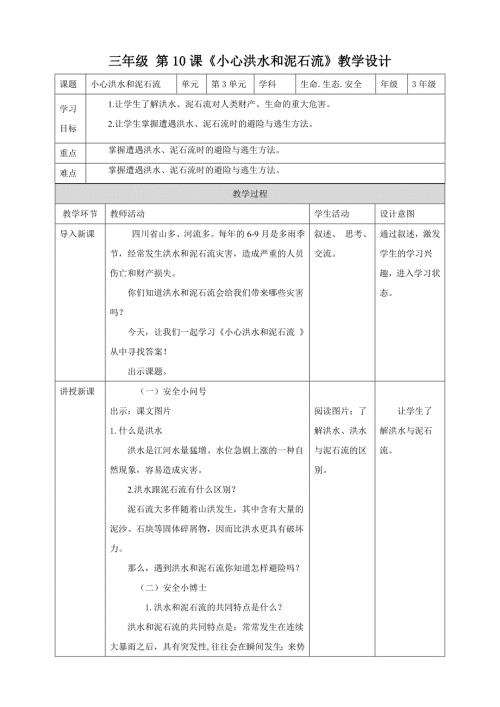
第10课《小心洪水和泥石流》教学设计
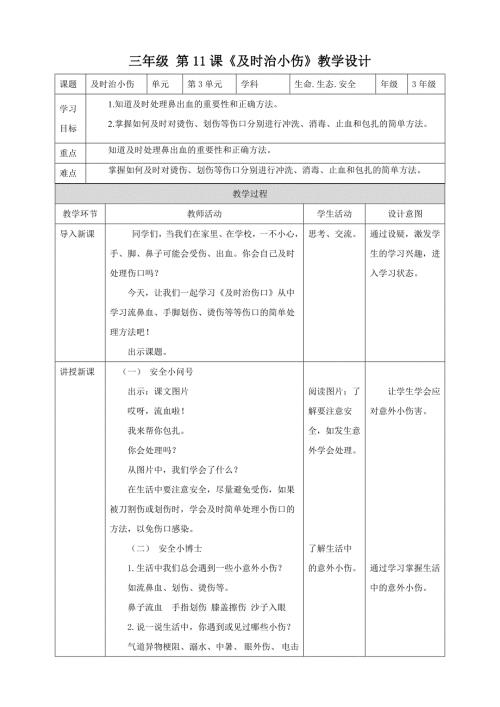
第11课《及时治小伤》教学设计
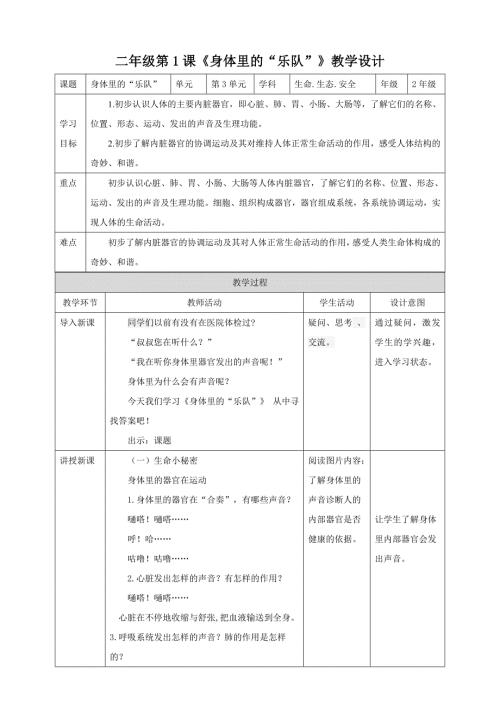
第1课《身体里的“乐队”》教案
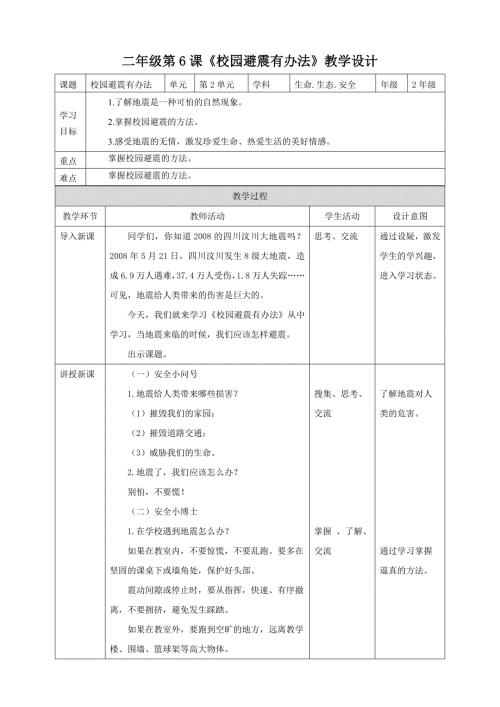
第6课《校园避震有办法》教学设计
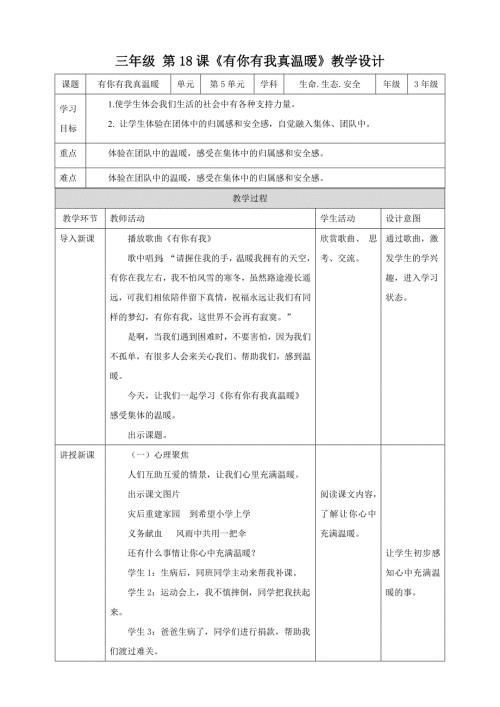
第18课《有你有我真温暖》教学设计
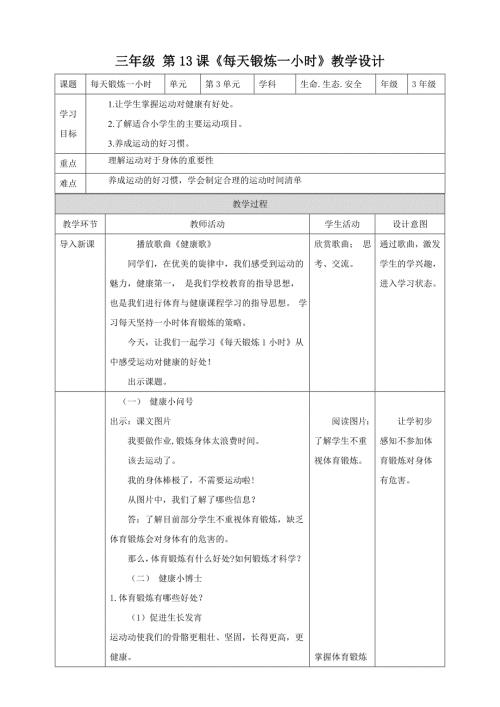
第13课《每天锻炼一小时》教学设计
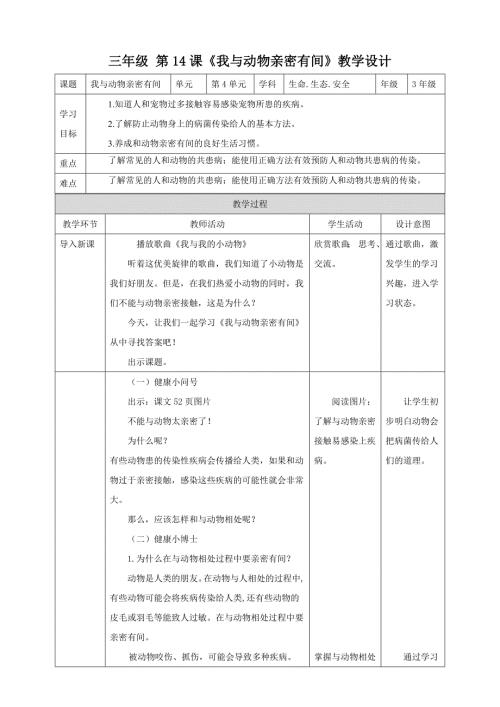
第14课《我与动物亲密有间》教学设计
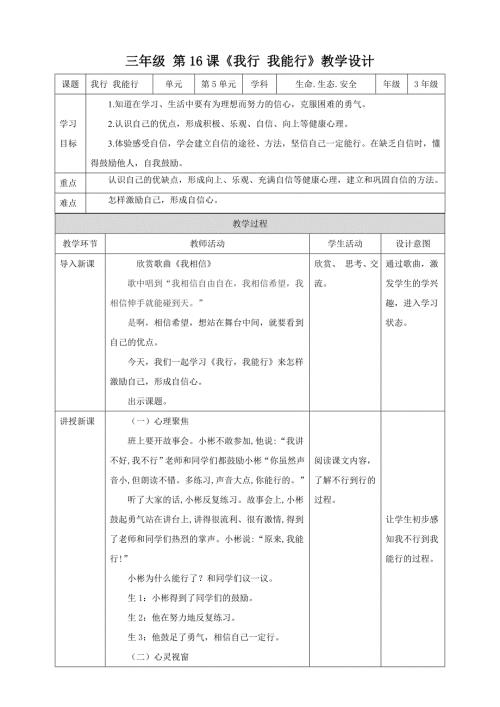
第16课《我行我能行》教学设计
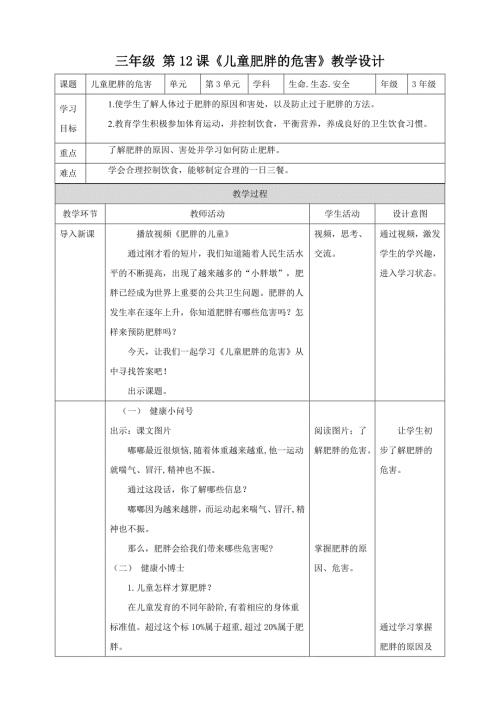
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页

