
高二化学课件:分子的空间构型
60页1、分子的空间构型,第一课时 价层互斥理论,一、形形色色的分子,H2O,CO2,1、三原子分子立体结构,直线形 180,V形 105,一、形形色色的分子,2、四原子分子立体结构,HCHO,NH3,平面三角形 120,三角锥形 107,3、五原子分子立体结构,一、形形色色的分子,CH4,正四面体,4、其它,一、形形色色的分子,P4,正四面体 60,C2H2,直线形 180,同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?,思考:,同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?,二、价层互斥理论,1.内容,对ABm型的分子或离子,中心原子A价层电子对(包括成键键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。,二、价层互斥理论,2.价层电子对(键电子对和未成键的孤对电子对),H2O,NH3,CO2,CH4,2,3,4,2,2,2,4,3,1,4,4,0,4,2,0,2,=键个数+中心原子上的孤对电子对个数,价层电子对数,键电子对数 = 与中心原子结
2、合的原子数,配位原子中卤素原子、H原子提供1个价电子, 氧和硫作为配位原子按不提供电子计算。,分子中价层电子对数的确定:,以ABm为例 (A中心原子,B配位原子) :,阳离子:中心原子的最外层电子数减去离子的电荷数;,阴离子: 中心原子的最外层电子数加上离子的电荷数),二、价层互斥理论,剖析内容,对ABn型的分子或离子,中心原子A价层电子对(包括成键键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。,排斥力最小,A,3.价电子对的空间构型即VSEPR模型,电子对数目:2 3 4 VSEPR模型:,二、价层互斥理论,直线,平面三角形,正四面体,应用反馈,4,3,空间构型,V形,平面三角形,V 形,4,平面三角形,四面体,四面体,SO42-,ABn 型分子的VSEPR模型和立体结构,2,3,平面 三角 形,2 0 AB2,直线形,3 0 AB3,2 1 AB2,价,层,电,子,对,数,平面三角形,V形,SO2,小结:,直线形,CO2 BeCl2,CH2O BF3 CO32-,模型,4,正
3、四面 体,4 0 AB4,3 1 AB3,2 2 AB2,正四面体 CH4,三角锥形,V形,H2O H2S,NH3 NCl3 SO32-,CH4 SiCl4 NH4+,知识拓展二:,三.等电子原理,具有相同价电子数(价电子总数)和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”。,1.若ABn型分子的中心原子A上没有未用于形 成共价键的孤对电子,运用价层电子对互斥模 型,下列说法正确的( ) A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形 C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确,C,牛刀小试,2.用价层电子对互斥模型判断SO3的分子构型 A、正四面体形 B、V形 C、三角锥形 D、平面三角形,D,课堂练习: 1、多原子分子的立体结构有多种,三原子分子的立体结构有 形和 形,大多数四原子分子采取 形和 形两种立体结构,五原子分子的立体结构中最常见的是 形。 2 、下列分子或离子中,不含有孤对电子的是 A、H2O、B、H3O+、C、NH3、D、NH4+ 3 、下列分子BCl3、CCl4、H2S、CS2中,其键角由
4、小到大的顺序为 4、以下分子或离子的结构为正四面体,且键角为10928 的是 CH4 NH4+ CH3Cl P4 SO42- A、 B、 C、 D、,直线,V,平面三角,三角锥, ,D,C,正四面体,分子的空间构型,第二课时杂化理论,写出碳原子的核外电子排布图,思考:,C原子与H原子结合形成的分子为什么是CH4,而不是CH2或CH3?,新问题2:,按照我们已经学过的价键理论,甲烷的4个C H单键 都应该是键,然而,碳原子的4个价层原子轨道是3 个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4 个氢原子的1s原子轨道重叠,不可能得到四面体构型 的甲烷分子,C,为了解决这一矛盾,鲍林提出了杂化轨道理论,例如: Sp3 杂化 CH4分子的形成,C:2s22p2,三、杂化理论简介,1.概念:在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。,2.要点:,(2)参与杂化的各原子轨道能量要相近(同一能级组或相近能级组的轨道);,(1)只有在形成分子的过程中原子轨道才能进行杂化,孤立的原子不可能发生
《高二化学课件:分子的空间构型》由会员hu****a8分享,可在线阅读,更多相关《高二化学课件:分子的空间构型》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
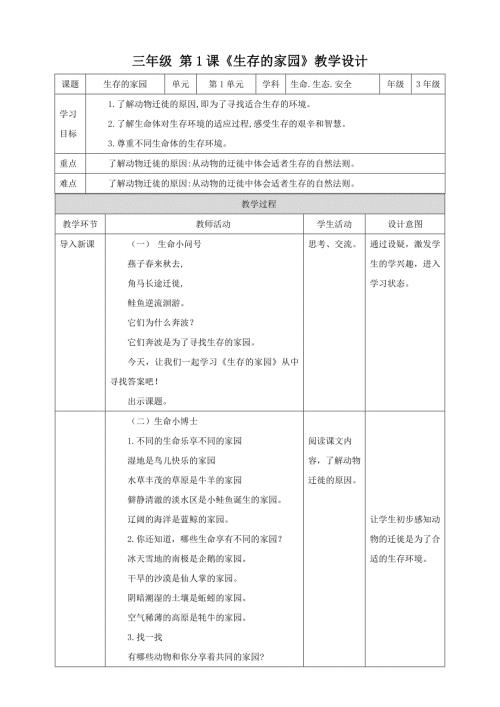
第1课《生存的家园》教学设计
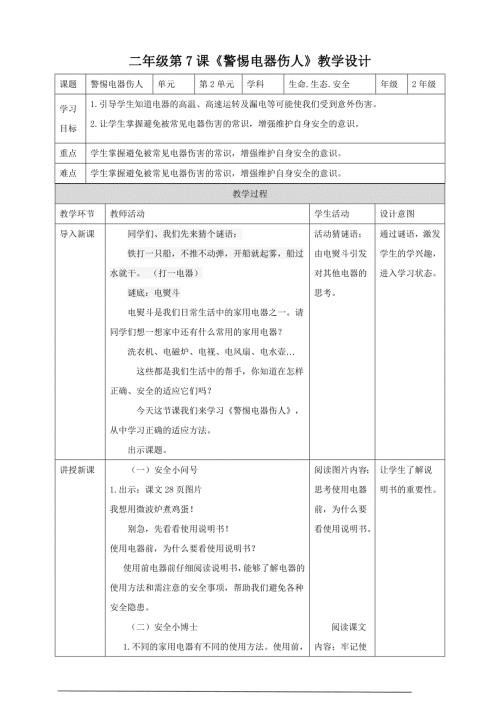
第7课《警惕电器伤人》教学设计
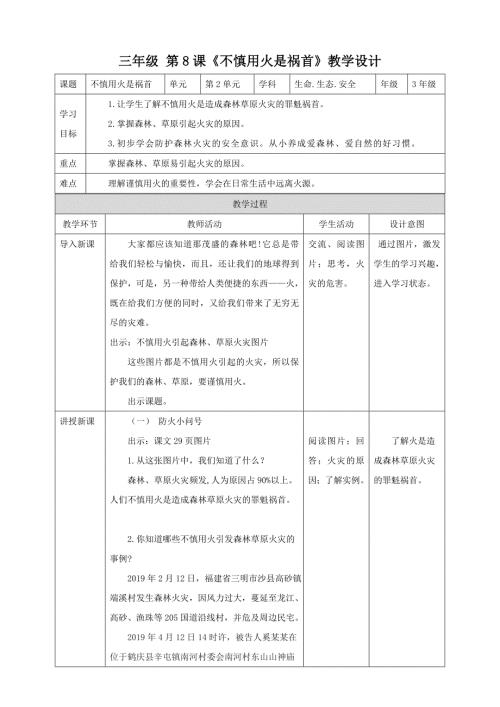
第8课《不慎用火是祸首》教学设计
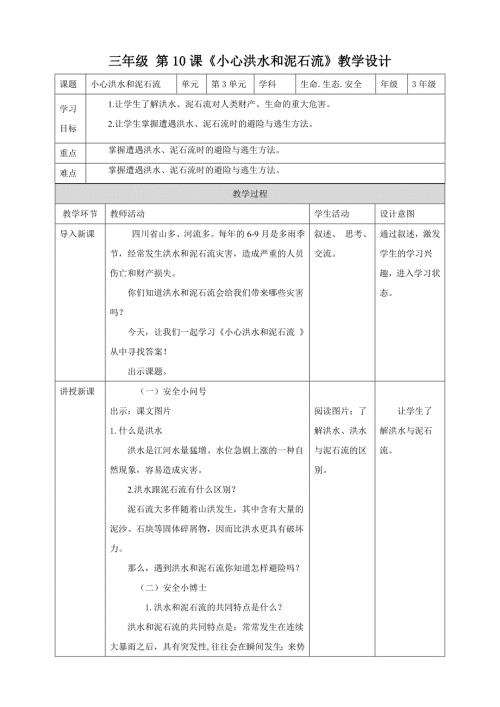
第10课《小心洪水和泥石流》教学设计
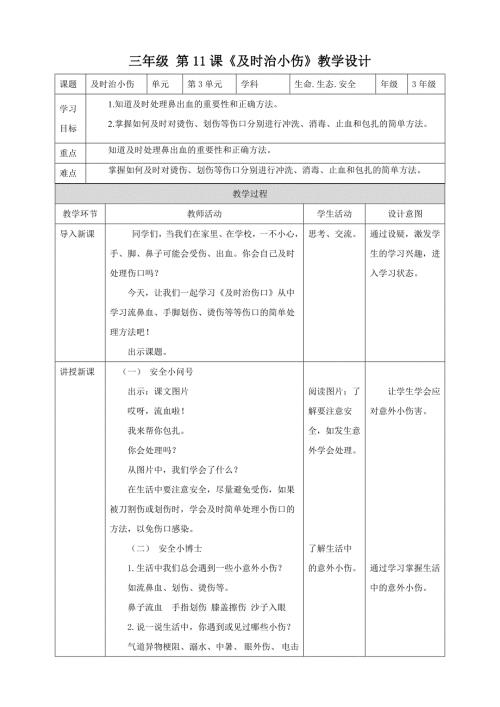
第11课《及时治小伤》教学设计
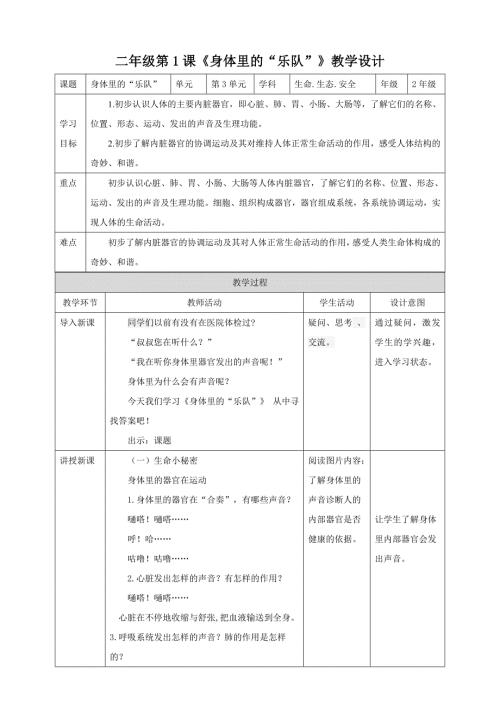
第1课《身体里的“乐队”》教案
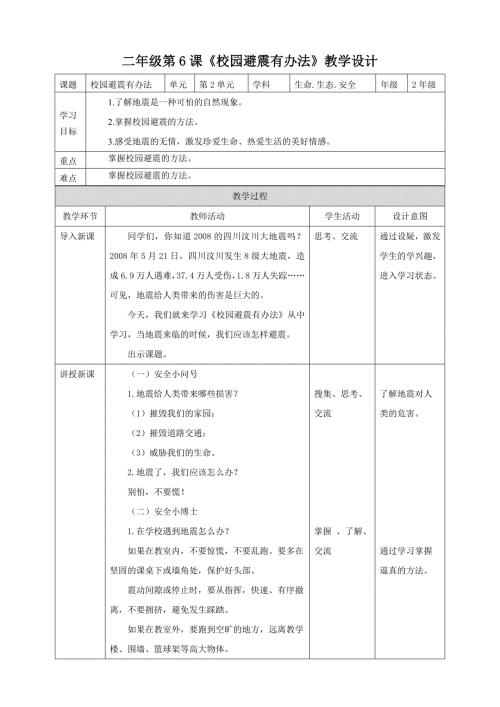
第6课《校园避震有办法》教学设计
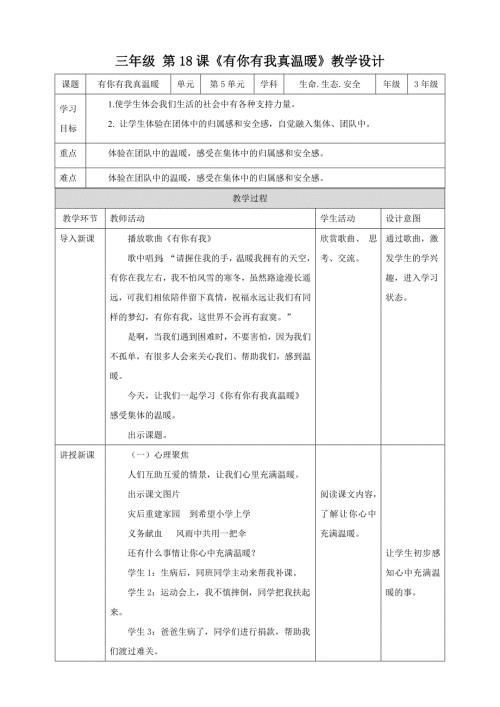
第18课《有你有我真温暖》教学设计
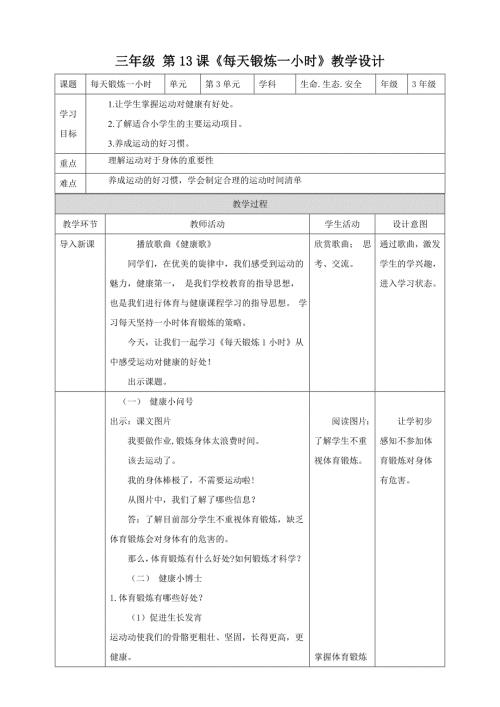
第13课《每天锻炼一小时》教学设计
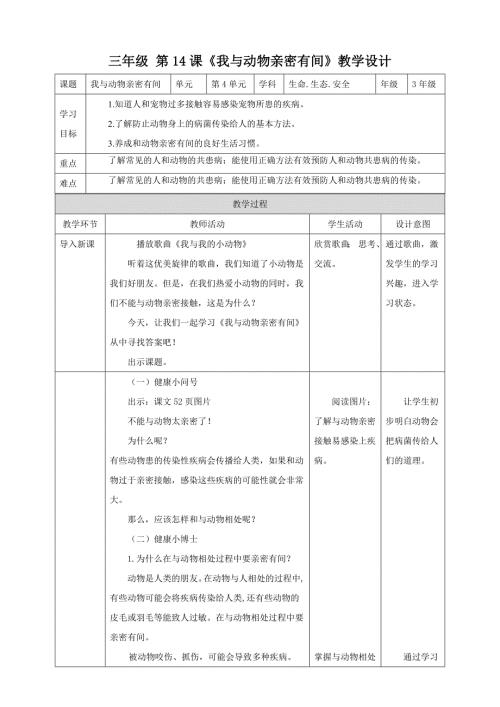
第14课《我与动物亲密有间》教学设计
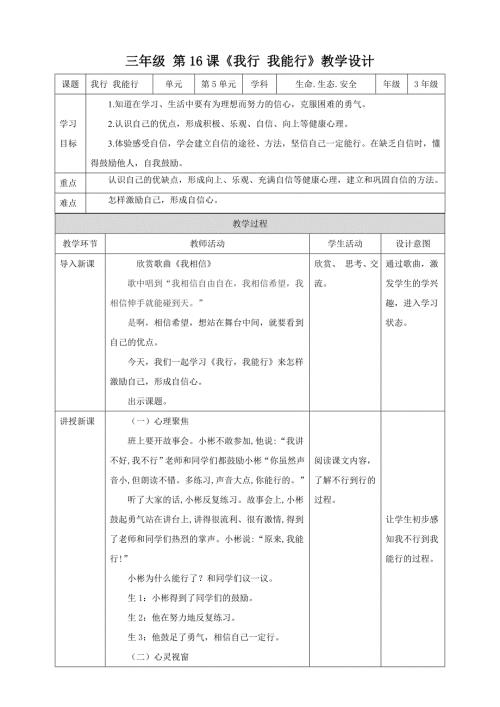
第16课《我行我能行》教学设计
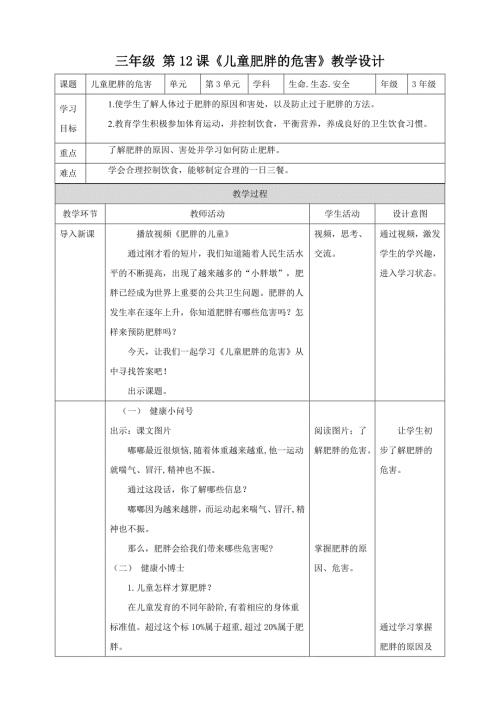
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页

