
高二化学课件:第一单元 化学反应速率与反应限度
41页1、第一单元 化学反应速率与反应限度,化学反应速率,我们学过的化学反应有快有慢 ,请举例说明。,【思考与交流】,较快,较慢,较慢,较快,专题 化学反应与能量 第一单元 化学反应速率和限度,一、化学反应的速率,在化学实验和日常生活中,我们经常观察到这样的现象: 有的化学反应进行得快,有的化学反应进行得慢。,进行下列实验,观察并比较两个反应的快慢。 取两支试管,分别加入5ml 0.5molL-1盐酸,再剪取相同大小的镁条和铁片,用砂纸打磨后,分别放入两支试管中。,表示化学反应进行快慢的量 反应速率,思考一:化学反应速率的定性表示,如:冒气泡快慢 颜色变化 固体量的减少 浑浊程度 温度的变化,我们通常可以通过某些现象的产生或消失的先后快慢来表示。,思考二:化学反应速率定量表示,那么化学反应速率如何定量表示呢?,回顾:物理学上怎样描述速度的?,一、化学反应速率,1、概念:,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。,单位: mol(Lh)-1 、 mol(L min) -1 、 mol(L s )-1 等,3、数学表达式:,衡量化学反应进行快慢程度的物理量。,2、表示方
2、法:,4、注意点,化学反应速率均为正值,没有负值;,表示的是一段时间内的平均速率;,例1、25时,一份双氧水样品经过2 h,H2O2的浓度从5102 mol L1下降到3102 mol L1 ,则该双氧水在这2 h中分解的平均速率约为_。,解: 5102 mol L1 3102 mol L1 V = 260 min = 1.67104 mol(Lmin)1,例题: 在2L的密闭容器中,充入N2和H2, 发生反应 N2 3 H2 2 NH3, 2 min后测得生成 NH3 0.12mol。 试计算分别用N2、H2和NH3表示的反应 的速率。 根据计算结果你能得出什么结论?,结论:在同一个化学反应里,用不同物质表示同一段时间内的化学反应速率时,其数值不一定相同,但意义相同,数值之比等于方程式中各物质的化学计量数之比。,v(N2) v(H2) v(NH3) 13 2,练习1: 已知 A 3B 2C 2D 在四种不同的情况下的化学反应速率分别为: v(A)0.15 mol(Ls)1 v(B)0.6 mol(Ls)1 v(C)0.4 mol(Ls)1 v(D)0.45 mol(Ls)1 该反应进
3、行的快慢顺序为,练习2: 在N2 3 H2 2 NH3中,经过一定时间后测得 NH3物质的量的浓度增加了0.6mol/L,在此时间内用H2表示的化学反应速率为v(H2)0.045mol(Lmin)1,则所经过的时间为多少?,反应物本身的性质(主要、内因) 不同物质间的化学反应,其反应速率是不相同的。,思考三:,决定化学反应速率大小的因素是什么?,反应条件(重要、次要、外因) 同一化学反应在不同条件下的反应速率不同。,哪些外界条件对化学反应速率有影响?,思考四:,实验1取两支试管,各加入5ml4%的过氧化氢溶液,再向试管中分别滴入几滴洗涤剂,将其中一支试管用水浴加热,观察并比较两支试管中的变化。,温度对 H2O2 分解速率的影响,产生气泡的 速率较快,其他条件一定时,温度越高,化学反应速率越快。,产生气泡的 速率较慢,1、温度对化学反应速率的影响,当其它条件不变时,升高温度可 加快化学反应速率。,注意:一般地温度每升高10,速率增至原来的24倍!,当其它条件不变时,降低温度可 减慢化学反应速率。,解释:,为什么夏季吃剩的饭菜要放在冰箱中保存? 为什么大多数反应需在加热的条件下进行?,练习
《高二化学课件:第一单元 化学反应速率与反应限度》由会员hu****a8分享,可在线阅读,更多相关《高二化学课件:第一单元 化学反应速率与反应限度》请在金锄头文库上搜索。

《小学生防溺水安全教育班会》教案

《中小学预防传染病知识主题班会》教案

《幼儿园防溺水安全教育班会》教案模板

小学开学第一课主题班会教案八篇

垃圾分类主题班会《保护环境 美化校园》教案

小学开学第一课主题班会教案和含演讲稿
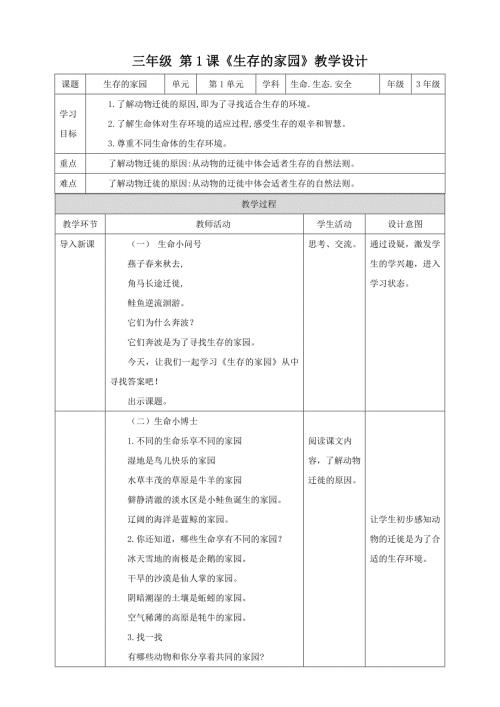
第1课《生存的家园》教学设计
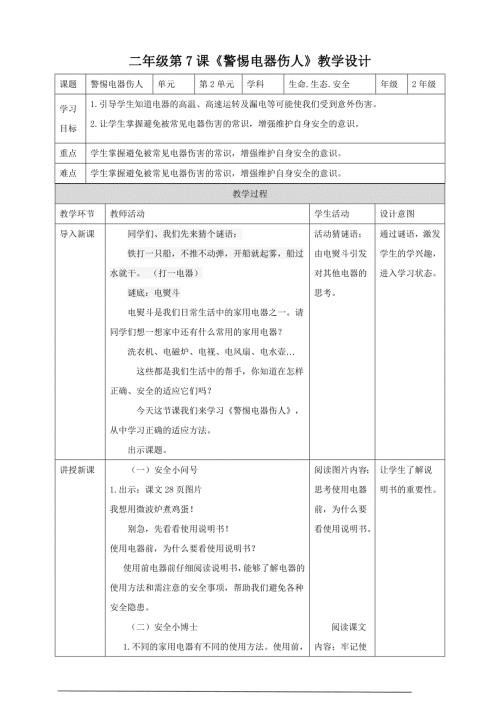
第7课《警惕电器伤人》教学设计
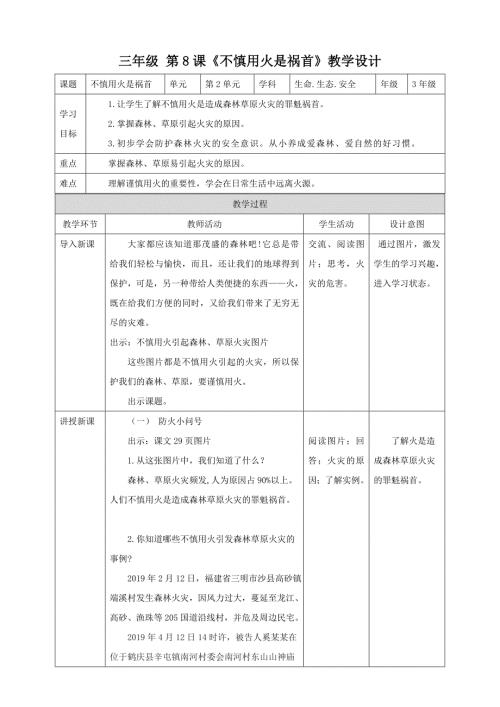
第8课《不慎用火是祸首》教学设计
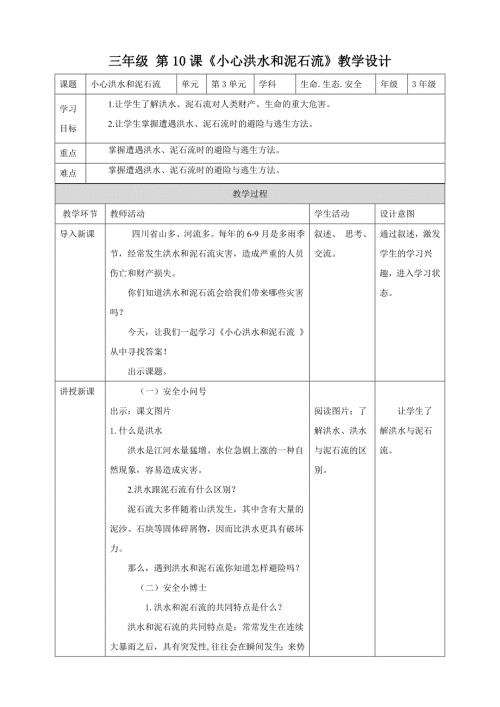
第10课《小心洪水和泥石流》教学设计
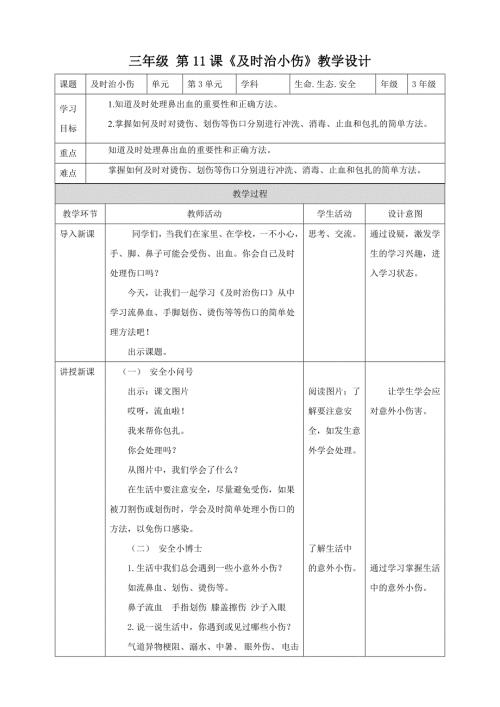
第11课《及时治小伤》教学设计
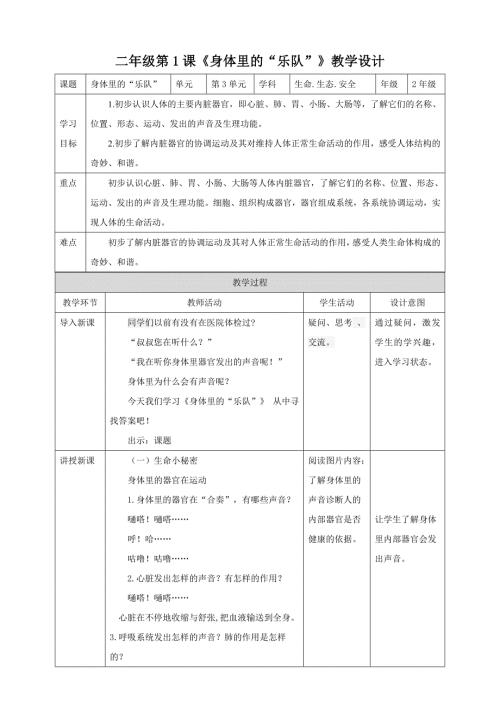
第1课《身体里的“乐队”》教案
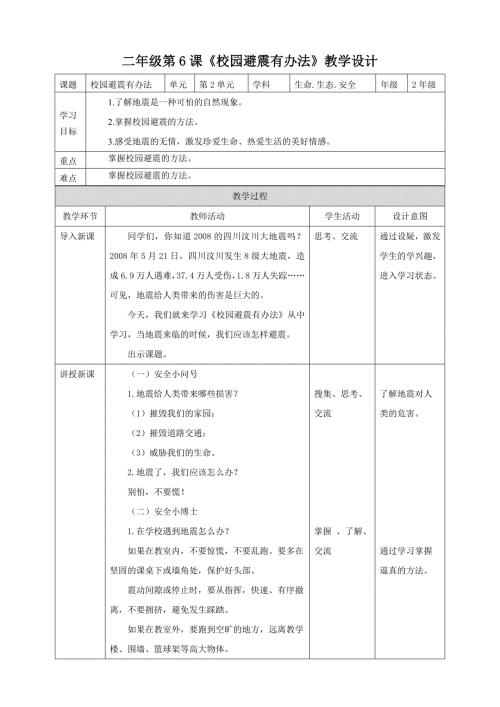
第6课《校园避震有办法》教学设计
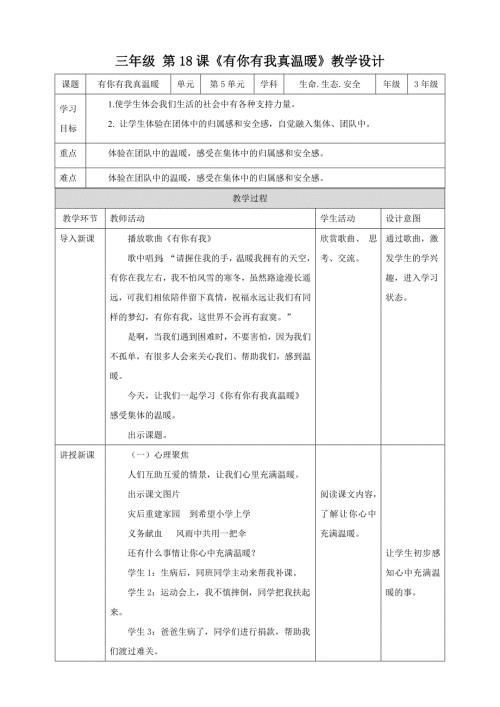
第18课《有你有我真温暖》教学设计
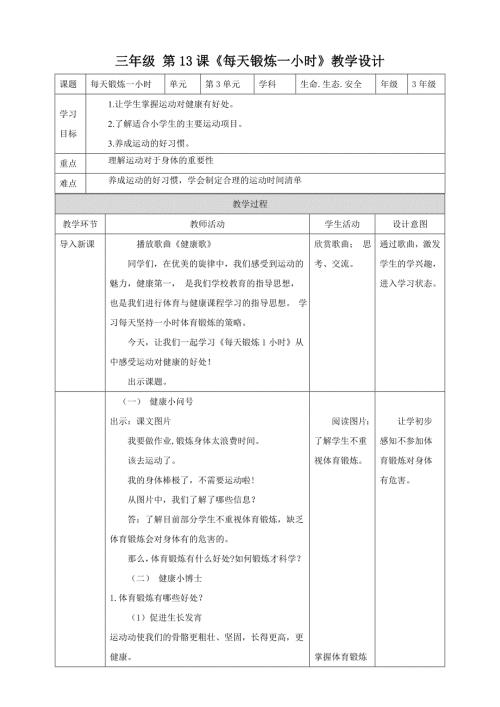
第13课《每天锻炼一小时》教学设计
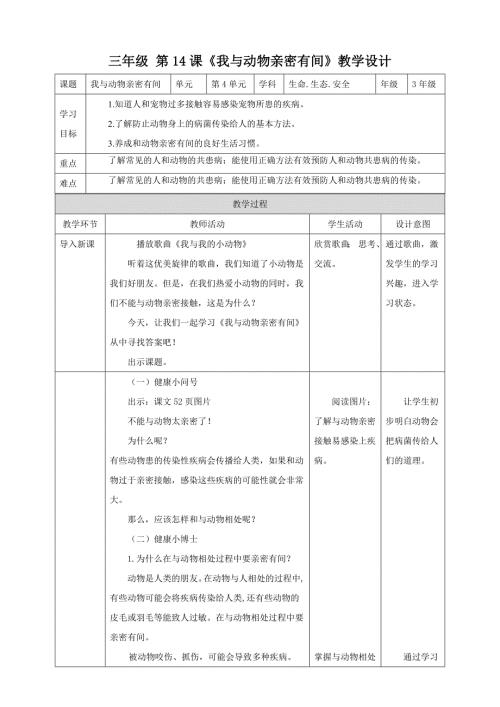
第14课《我与动物亲密有间》教学设计
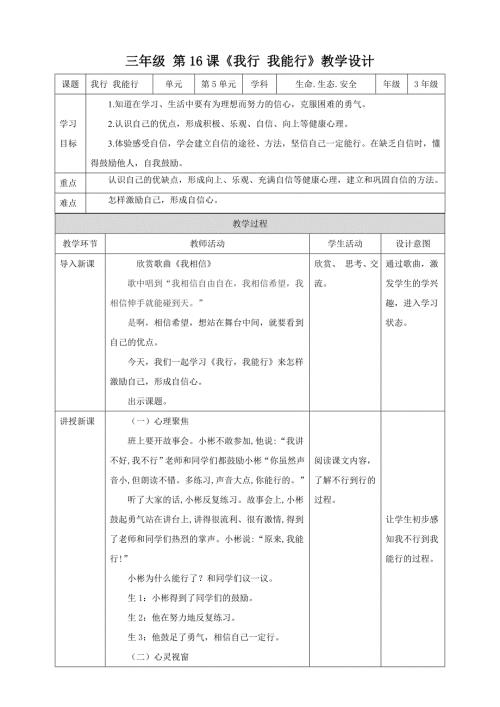
第16课《我行我能行》教学设计
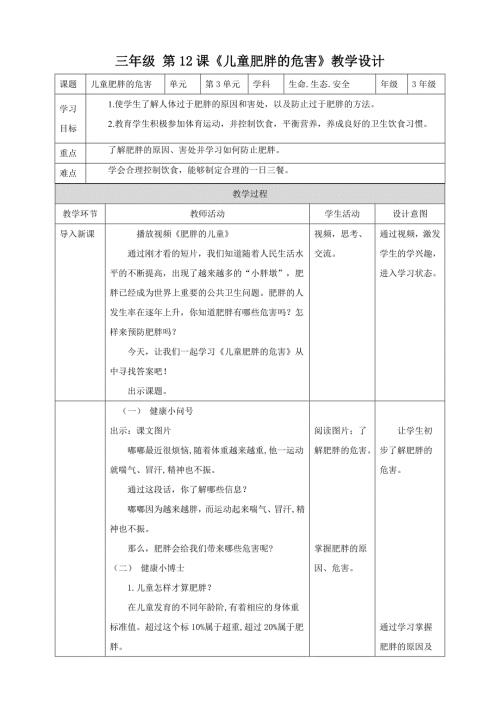
第12课《儿童肥胖的危害》教学设计

第17课《美丽的插花》教学设计

第8课《我和规则做朋友》教学设计
 通用技术专题1-技术极其巨大的作用
通用技术专题1-技术极其巨大的作用
2024-04-18 21页
 【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
【高中语文】《子路+曾皙+冉有+公西华侍坐》课件+统编版高中语文必修下册 ++
2024-04-16 46页
 【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
【高中语文】《装在套子里的人》课件+统编版高中语文必修下册
2024-04-16 18页
 【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
【高中语文】《望海潮》课件+统编版高中语文选择性必修下册
2024-04-16 39页
 【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
【高中语文】《齐桓晋文之事》课件+高一下学期语文大单元教学同步备课课件(统编版必修下册)
2024-04-16 27页
 【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
【高中语文】《荷花淀》+高二语文同步精讲精读课件(统编版选择性必修中册)
2024-04-16 38页
 【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
【课件】Unit+1Reading+for+Writing人教版(2019)选择性必修第二册
2024-04-15 34页
 【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
【课件】Unit+1Reading+for+writing课件人教版选择性必修第一册+
2024-04-15 34页
 【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
【课件】Unit+1Art+Reading+for+writing+课件(2019)选择性必修第三册
2024-04-15 30页
 4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
4.1《望海潮》课件2023-2024学年统编版高中语文选择性必修下册
2024-04-15 39页

