
动态心电图系统注册技术审查指导原则
11页1、附件2动态心电图系统注册技术审查指导原则本指导原则旨在指导注册申请人对动态心电图系统注册申报资料的准备及撰写,指导和规范动态心电图系统的技术审评工作,帮助审评人员理解和掌握该类产品结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。本指导原则所确定的核心内容是在目前的科学认知水平和产品技术基础上形成的。因此,注册申请人和审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。本指导原则不作为法规强制执行,不包括行政审批要求。注册申请人和审评人员需密切关注相关法规的变化,确认申报产品是否符合法规要求。一、适用范围本指导原则适用于YY 08852013中定义的动态心电图系统。动态心电图系统用于连续记录和分析人体的心电图,供临床诊断,管理类别为二类。本指导原则的范围不适用于心电图机和心电监护设备,以及不能对心电图进行连续记录和分析的系统(例如:间歇事件记录仪)。二、技术审查要点(一)产品名称要求动态心电图系统的产品命名应符合医疗器械通用名称命名规则(国家食品药品监督管理总局令第19号)和国家标准、行业标准中的通用名称要求,
2、按核心词+特征词的方式命名,如动态心电图机、动态心电图系统。(二)产品的结构和组成动态心电图系统通常由动态记录仪、心电导联线、心电电极、记录读取设备和动态心电分析软件组成。动态记录仪是指患者随身佩戴或携带的,可以连续记录心脏活动电位的记录设备。动态记录仪一般为内部电源供电设备。心电导联线连接于动态记录仪和心电电极之间,用于传递人体体表采集的心电信号。心电电极一般采用一次性心电电极,通常为单独注册的二类医疗器械。动态心电分析软件对动态记录仪采集和记录的心电波群进行形态和节律分析,供临床诊断。制造商应根据具体产品情况确定产品的结构组成。(三)产品工作原理/作用机理动态记录仪通过放置在患者体表的心电电极,获取患者心脏活动电位,记录各测量点间电位差得到心电图信号。动态心电分析软件将相关心电数据信息进行回放、分析、分类和统计。(四)注册单元划分的原则和实例产品注册单元的划分应考虑工作原理、性能结构是否相同,采用同一工作原理且性能结构相同则可以作为一个注册单元。目前动态心电图系统的工作原理基本相同,因此重点关注产品的性能结构是否相同。(五)产品适用的相关标准动态心电图系统主要参考如下标准:表1相关
3、产品标准标准编号标准名称GB 9706.12007医用电气设备 第1部分:安全通用要求GB/T 1912008包装储运图示标志GB/T 147102009医用电器环境要求及试验方法GB/T 16886.12011医疗器械生物学评价 第1部分:评价与试验GB/T 16886.52005医疗器械生物学评价 第5部分:体外细胞毒性试验GB/T 16886.102005医疗器械生物学评价 第10部分:刺激与迟发性超敏反应试验GB/T 16886.122005医疗器械生物学评价 第12部分:样品制备与参照样品GB/T 25000.512010软件工程 软件产品质量要求和评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则YY/T 03162016医疗器械 风险管理对医疗器械的应用YY 05052012医用电气设备 第1-2部分:安全通用标准 并列标准:电磁兼容要求和试验YY 08852013动态心电图系统安全和基本性能专用要求YY/T 0466.12009医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求YY/T 06642008医疗器械软件 软件生存周期过程Y
4、Y/T 07082009医用电器设备 第1-4部分:安全通用要求并列标准:可编程医用电气系统YY/T 14742016医疗器械可用性工程对医疗器械的应用如有新版强制性国家标准、行业标准发布实施,产品技术要求应执行最新版本的国家标准、行业标准。(六)产品的适用范围/预期用途、禁忌症动态心电图系统用于采集、测量、存储、回放和分析动态心电图,供临床诊断。根据临床评价资料,动态心电图系统应明确适用的人群。禁忌症:尚未明确。(七)产品的研究要求1.产品性能研究产品性能研究部分,应列出产品适用的国家标准和行业标准,并对适用标准中的不适用项目做出说明。产品性能研究应结合国家标准和行业标准,对产品技术要求涉及的实用功能性、临床有效性、应用安全性(电气安全与电磁兼容)及质量控制指标进行研究,给出相应的结构、方法和标准。研究资料应从产品设计角度,详细说明性能指标的确定依据,例如:心电采样率设定的依据,起搏心电采样率设定的依据等。2.生物相容性评价研究依据GB/T 16886相关标准,进行生物相容性评价。可根据关于印发医疗器械生物学评价和审查指南的通知(国食药监械2007345号)进行生物学评价。3.灭菌和
《动态心电图系统注册技术审查指导原则》由会员jiups****uk12分享,可在线阅读,更多相关《动态心电图系统注册技术审查指导原则》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
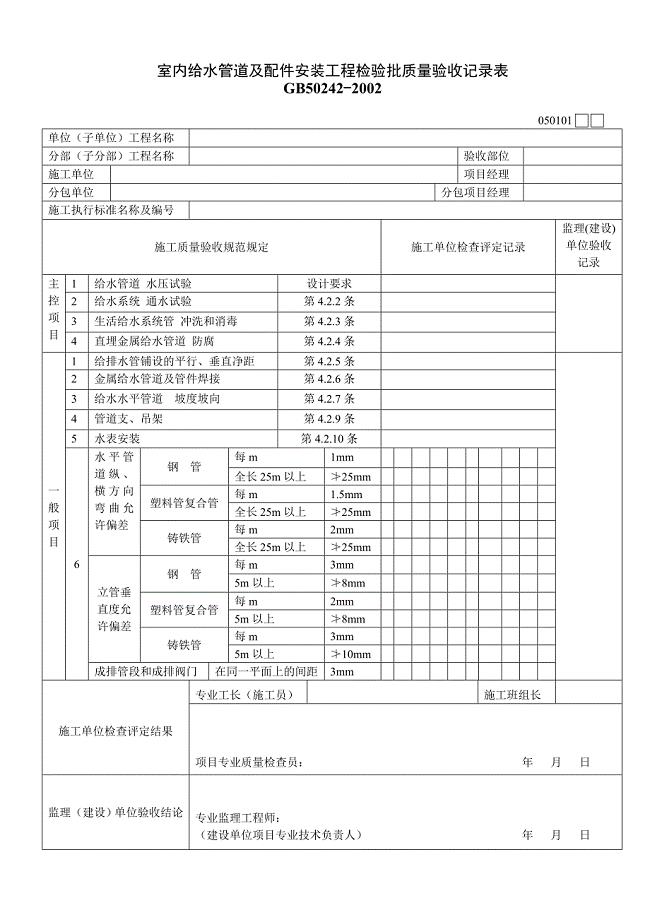
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 2024年安徽省芜湖市中考二模语文试卷【含答案】
2024年安徽省芜湖市中考二模语文试卷【含答案】
2024-04-24 10页
 2024届河北省邯郸市中考一模语文试题【含答案】
2024届河北省邯郸市中考一模语文试题【含答案】
2024-04-24 10页
 2024年(6月份)中考数学押题试卷【含答案】
2024年(6月份)中考数学押题试卷【含答案】
2024-04-24 25页
 2024年江苏省扬州市宝应县中考一模语文试题【含答案】
2024年江苏省扬州市宝应县中考一模语文试题【含答案】
2024-04-24 10页
 辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
辽宁省本溪市2022-2023学年高中下学期学业水平考试美术试题【含答案】
2024-04-23 4页
 第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
第六单元 正比例和反比例 (单元测试卷)苏教版数学六年级下册【含答案】
2024-04-23 10页
 江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
江苏省无锡市2024年七年级下学期期中数学调研试卷【含答案】
2024-04-23 19页
 江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
江苏省江阴市华士片2022-2023学年七年级下学期期中语文试题【含答案】
2024-04-23 10页
 江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
江苏省泰州兴化市2023-2024学年高一下学期期中考试语文试题【含答案】
2024-04-23 16页
 小学六年级体育与健康测试题【含答案】
小学六年级体育与健康测试题【含答案】
2024-04-23 5页

