
体细胞治疗人体试验申请与操作规范.
33页1、體細胞治療人體試驗申請與操作規範92.11.04衛署醫字第九二二二四七七號公告第一章 總 則一、目的為確保體細胞新醫療技術人體試驗合乎學術性、安全性及社會倫理性,並確保受試者之權益,特定訂本規範。二、體細胞療法之定義本規範所稱體細胞療法(somatic cell therapy)係指使用取自病患同種自體(Autologous)、同種異體(Allogeneic )或異種異體(Xenogeneic)或其他經中央主管機關核准之體細胞或胚胎幹細胞,並經體外培養後所衍生的細胞,以達到疾病治療、診斷或預防目的之醫療技術。三、體細胞療法之適用原則1.限於威脅生命或明顯影響生活品質之疾病。2.依據臨床前學術研究成果或國外研究經驗,預測體細胞療法之治療效果較現行之治療方法更為優異,或體細胞療法配合現行療法使用,可提升治療之效果。3.有充分的科學根據,可預測體細胞療法對受試者是利多於弊之治療方式。4.僅限於針對病患個人體細胞組織、器官或系統所施用之體細胞療法。5.絕對禁止進行涉及或會影響人類生殖遺傳功能之體細胞療法,包括以個人的體或幹細胞核轉殖入去核的卵細胞,或以其他方法複製人類個體。四、療效性與安全性體
2、細胞療法應符合下列關於療效性及安全性之要求1.體細胞療法之療效性確認,必須有充分的學術理論以及臨床前人體試驗的實驗數據,證明可能具有療效性和安全性,或經中央主管機關認定之國家,所核准進行人體試驗之體細胞療法或相關細胞組織的醫療方法。2.重視受試者之安全,包括篩檢同種異體或異種異體的細胞可能含帶之感染病原與免疫障礙性,並應確實遵守保護受試者之相關規範(參閱附件相關法規)。3.施行避免體細胞在體外運送、保存或培養中,可能遭受病原污染之措施,包括優良實驗室之操作與設備。4.絕對禁止進行涉及或會影響人類生殖遺傳功能之體細胞療術,包括以個人的體細胞核轉殖入去核的卵細胞,或以其他方法複製人類個體。又,直接採取受孕十四天以上之人類胚胎為原料繁殖分化,成為特殊細胞組織而使用於病人之體細胞療術亦絕對禁止。5.確保生物安全性及公共衛生:絕對避免體細胞療法引發傳染疾病之散布,或產生能夠傳染人類之新病原的可能性,包括同種異體(Allogeneic human)或異種異體(Xenogeneicanimal)之體細胞使用,或以這些細胞培養過程或使用中,可能引發內源病毒基因體(Endogenous viruslik
3、e genome)之表現(例如豬細胞內含反轉錄病毒)(例如豬細胞內含反轉錄病毒),或直接或經由基因組合之機制而產生會感染人類之病原,應有事先防範,以及確保研究人員工作環境及週圍之安全。第二章 申請程序一、申請機構資格(一)教學醫院(以下簡稱醫院)。(二)試驗主持人及主要協同人員曾接受人體試驗、細胞治療實驗室規範及相關訓練。(三)所使用之細胞治療實驗室,應符合相關實驗室標準規範。(四)醫院人體試驗審議委員會之設置與功能,應符合新醫療技術人體試驗申請與審查作業程序之規定。委員會審議試驗計畫時,必要時,得邀請分子生物學、細胞生物學、基因學或臨床藥理學專家參與討論。二、申請必要文件醫院向申請施行體細胞治療人體試驗,應檢具下列文件:(一)人體試驗計畫書(格式如附件二)(二)完成實驗室或動物實驗之研究報告(三)醫院人體試驗委員會審查通過之證明文件(格式如附件)(四)接受試驗者同意書(格式如附件三)(五)人體試驗涉及於人體施行新醫療器材者,應檢附產品之安全性與醫療效能證明文件。(六)提出產品品質證明文件。三、申請作業醫院申請體細胞治療人體試驗,應提經該院人體試驗委員會審議通過,依醫療法第五十六條、同
4、法施行細則第五十條及新醫療技術人體試驗計畫作業規範之程序規定,向本署提出人體試驗計畫書(計畫書格式及填寫說明,如附件)。第三章 受試者之權益維護一、受試者之選擇基於尊重個人尊嚴並維護人權,在選擇受試者時,除考量臨床研究所必要之科學條件外,並應慎重考慮可能受試者之病況、年齡與決定能力等因素。二、對可能受試者(Candidates)之說明和對答要點體細胞療法研究係運用相當先進的技術,操作過程中可能產生不能預測之風險,計畫主持人應以一般人得以理解的方式及用詞,審慎對可能受試者預先作清楚、完整之說明,並詳盡回答可能受試者之問題。說明項目之要點如下:(一)醫院將盡力維護受試者在試驗施行期間之權益,並善盡醫療上必要之注意。(二)體細胞療法人體試驗之目的、方法及預期之醫療效能。(三)體細胞療法可能產生之併發症、副作用、危險及其處理方法。(四)受試者於試驗施行期間中,可隨時無條件撤回同意,退出試驗。但退出試驗後,醫院得提供與受試者已接受之試驗相關之必要追蹤檢查;受試者退出試驗,將不影響醫病關係或醫療上的正當權益。(五)受試者隱私權之保障。(六)其他維護受試者權益之相關事項。三、受試者同意之獲取程序(一
5、)獲取同意前必須由計畫主持人或由主持人選定之研究人員親自向受試候選者或其法定代理人作口頭說明,解釋同意書內容及答覆有關之問題。(二)經說明和答覆後,若可能受試者同意接受該體細胞療法之人體試驗,應由其本人簽署同意書,在受試者本人無行為能力時,由其法定代理人代為簽署。第四章 審查作業一、行政初審本署受理體細胞療法人體試驗計畫申請後,應即進行行政審查作業,若所提計畫之文件內容有不足部分,應於收件後二週內通知申請機構暨計畫主持人補送相關文件(補件通知格式如附件四)。二、專家審查(一)經初審齊備之體細胞療法人體試驗計畫申請案,由本署委請聘請國內外相關特殊醫學領域(並與該計畫主持人或機構無利益關係)二位專家學者擔任評審。(二)專家學者之評審意見及建議應於收文後一個月內以書面(如附件)回覆本署。異議或建議儘量以切實之字句和言詞表達,避免主觀泛貶或泛譽的辭句。(三)專家審查重點如下:1.該體細胞療法是否有合理之科學理論、研究背景?國內外是否有相同或相類似之人體試驗案例已經完成或正在進行?此計畫有何特殊學術意義或預期之療效性?2.體細胞來源是屬同種自體(autologous) 、同種異體(Allogen
6、eic)或異種異體 ,(Xenogeneic)?若屬後二者,是否可能產生嚴重免疫問題,或其他副作用或危害?有否預防措施?3.體細胞醫藥療品若屬生技公司產品,該公司是否有該產品之合法證明?若體細胞之培養與醫療品配製在主持人機構之實驗室執行,則實驗室之細胞產品操作程序是否妥善?4.臨床作業部分是否適當?有否標準作業程序(SOP)之建立?5.研究人員及主持人之資歷及專業訓練經驗是否足以執行該細胞療法人體試驗,確保不會偏離預期成果,以保護受試者之權益及安全?6.細胞培養及配製步驟是否可避免細菌或病毒污染?有否使用優良實驗室硬體設備及軟體標準操作程序(SOP)?7.體細胞療法人體試驗受試者同意書是否合理?8.對於使用之體細胞剩餘材料的處理方式,應說明如何處理。三、本署醫事審議委員會審核(一)專家審查意見及計畫主持人答覆意見收齊後,應即提送本署醫事審議委員會審查。該會必要時,得邀請計畫主持人及主要研究人員列席說明並答覆問題。擔任評審之專家學者亦得列席提供意見並參加討論。(二)本署醫事審議委員會應參酌專家之學術科技審查結果,慎重考量該計畫對我國特殊疾病問題、醫學研究之推展及醫藥生療科技企業之重要性,
7、研究結果可能之倫理、法律、社會衝擊,經開會聽取主持人報告和專家之意見再討論後,將個別體細胞療法人體試驗計畫核定為照原計畫通過、修正後可通過或不通過。四、審查結果審查結果通知人體試驗計畫經醫事審議委員會審查核定之後,應於七日內將審查結果函復申請機構。第五章 品質管控一、執行進度報告凡經核准進行的體細胞療法人體試驗,計畫主持人應於核准後每六個月一次向本署提出進度報告(執行情形報告表格式如附件七),由本署提醫事審議委員會進行書面審議,以確定計畫是否順利進行。二、危害事件報告經核可準之體細胞療法計畫,在執行期間若發生受試者死亡、嚴重副作用、不良反應,或公共衛生上之重大風險者,主持人應於二十四小時內,向機構首長報告。如認為有安全之虞,應即停止計畫,並向主管機關報告。機構首長應即委派機構內人體試驗委員會進行事故原因之調查,檢討並提出處理措施(包括中止試驗計畫)。並於一週內向本署提出書面報告。三、衛生主管機關監測鑑於體細胞療法之新穎性與不確定性,衛生主管單位連同機構內人體試驗委員會應隨時可以主動派員實地查核研究計畫之執行狀況,確定是否依原訂計畫進行,以及受試者之權益是否確實受到保障。四、執行成果報告
8、體細胞療法人體試驗計畫期程結束後三個月內,計畫主持人應備妥執行成果報告書一式兩份,函送本署備查(成果報告書格式如附件)。在試驗計畫結束後,受試者若產生長期性的效果或副作用,亦應報告本署。附件附件一相關法規(略)附件二體細胞療法人體試驗計畫書計畫名稱:(中文)_(英文)_申請機構:_主持人:_簽名:_聯絡電話:_ 傳真:_網址:_填報日期:_附件二之說明體細胞治療人體試驗計畫書填寫說明一、計畫書及摘要:一式二份,並附計畫書電腦檔案。計畫撰寫以中文為主,英文亦可。專門名詞得用英文,但必有中文和英文摘要,英文計畫書必有較詳細之中文摘要。敘述以儘量能為非專業讀者可理解為目的。二、試驗主題及目的:主題、目的敘述外,並說明試驗之各期階段(PhaseI,II,orIII)。三、學術背景:(一)理論根據:需闡明為何要選擇細胞療法治療此特殊疾病,目前此疾病有否其他治療方法以及其利弊。列舉國內外相關之基礎研究報告,包括實驗觀察、動物模型研究、臨床前研究、演譯(由實驗室轉到臨床應用)的研究,以及國內外之相似臨床試驗和政府批准情況。預測細胞療法是否可達到治療疾病、改進症狀及徵候、抑制病情惡化或改善患者生活品質
9、(不能避免惡化,但可減輕痛苦)。(二)臨床前研究:敘述和列舉計畫主持人及研究人員對所提人體試驗方案事先預備的考量以及各種臨床前的研發成果,包括:1.給予體細胞之來源 (donor sources) 是屬受試者同種自體(autologous)、同種異體(Allogeneic)或異種異體(Xenogeneic),及所使用之細胞組織之功用。如屬幹細胞,則註明是體幹細胞種類(組織器官來源)、胚胎細胞或體細胞核移植入卵細胞衍化之幹原細胞 (stem cells),必須提供其來源之證明,以及特殊治療用途之證明。2.選擇授予者(donors) 細胞之標準:(1)同種自體(Autologous) 細胞及衍生細胞藥品:研究單位必須設有檢驗傳染病原(adventitious agents),如愛滋病毒(HIV) 和肝炎病毒(hepatitis viruses)之作業,可以不選擇這種受試者,或對這種特殊受試者事先作保護工作人員及環境之防患措施。(2)同類異體(Allogeneic):此種體細胞之選擇,至少必須符合血液輸給療法或骨髓移植治療術之規定,以及敘述有關之臨床前測定其療效性及安全性之結果。包括受試者和
10、授予者的HLA-I和(或)HLA-II等組織適合性抗原(histocompatibility autigens)同異之測定方法,以及授予者之選擇標準。若此種體細胞或其衍生細胞藥品或器具,將施用於所有受試者(general use),必須提供有關安全性和療效性之臨床前研究的充分證據,包括各種傳染病原之檢驗(附表一)。(3)異種異體 (Xenogeneic):如果體細胞療法研究將使用異種(動物)之體細胞或其衍生之細胞組織藥品,則必須提供充分臨床前研究的數據,證明對受試者無短期或長期性之風險,以及無危害公共衛生之可能,例如動物細胞之內涵性(indigenous) 或內原性(endogenous) 基因成分,這種基因成分本身可能對動物或人類不會致病,但在人體內,可能產生基因組合而產生致病性和傳染性之病原物。3.體細胞產品之施用方法及穩定性:臨床前研究必須包括體細胞療法如何施用於人體的方法(如手術植入器官、靜動脈注射或其他注射方法)、體細胞在體內之存留時間,以及在體內會不會改變其機能?四、試驗方法:(一)接受試驗者標準及數目:1.預計需要多少病人參與?2.預期每年能找到多少個符合資格的病人?3.
11、病人的來源。4.使用何種標準選擇受試對象?合格病人和不合格病人的選擇標準為何?5.如果無法接受所有想參與的病人,如何加以挑選?(二)試驗期限及進度(三)試驗設計及進行方法:1.體細胞醫藥品製配作業:(1)說明採取同種自體或異種異體者體細胞或組織之方法,是否由專科醫師執行?採取之細胞組織如何和利用目的吻合?感染症或病原之檢查項目及檢驗方法,包括感染病原抗體出現之空窗期。若使用不同類動物之細胞藥品,則如何確定提供來源之可靠性及其品質之穩定性,可符合試驗目的之要求。(2)細胞培養方法:包括是否繁殖、如何繁殖、如何促使治療性機能或性質之表現和保持此性質之穩定性,而且必須敘述如何避免細菌和其產物之污染,細胞培養液是否使用自體血清、人類血清球蛋白 (human serum albuminglobumin)、人類異體(如:AB 型)血清、胎牛血清及(或)細胞生長素分化刺激等藥物?如何確保這些培養液添加物之安全性(包括內涵性或內原性病毒之檢查)?有沒有細胞培養之特別設備?(3)細胞庫存:是否及如何建立種源細胞庫(master cell banks)、使用細胞庫(working cell banks)
12、以及治療用細胞(therapeutic cells)之庫存,以何方法保持細胞活性及治療用之性質。如何避免庫存作業產生污染物之介入,以及如何庫存細胞,尤其標誌治療用細胞劑之庫存,避免不同病人之混淆、使用。(4)優良實驗室操作之特殊軟體作業及特殊硬體設備,以及工作人員之訓練。(5)品管作業:敘述使用之各種品質管控之方法,包括如何鑑定細胞之確實身分(identity)、如何查驗細胞族群(various heterogeneous cell populations with polymorphisms)及可能產生之變異種(variants)或突變種(mutants)、利用於治療的特殊細胞機能和性質之定性和定量方法,以及污染細菌、病毒及其產物之檢驗方法。並設定例行測試(routine tests)和特殊測試(special tests)之作業。1. 臨床作業:說明臨床治療方法,以及確認治療成敗與否的診斷方法。如計畫主持人或他人(據文獻報告或私人通訊)曾在先前的臨床試驗中以類似方法治療過病人,應該指出彼此的相關性及此計畫的特異處,特別是下述諸點:(1)自病人或授予者(捐贈者)體內取出的體細胞是否隨
13、後在體外培養使產生治療性質(即治療性的處理)?如果是,則應說明取出的細胞種類、數目和多久要重複取一次。(2)病人接受細胞療法前之預備措施。(3)病人是否經過某些治療方法(如放射治療或化學治療),以增加體細胞療法之治療效果或減少病人排斥輸入之異種細胞?(4)把何種體外培養的細胞輸給病人?以何法送入病人體內?所用細胞的體積如何?治療一次或多次?如為多次,其間隔時間多久?(5)如何確定送入體內的細胞有療效?此等細胞是否僅限於計畫中特定細胞族群?分析法的敏感度如何?(6)如何研究在上述治療過程中,是否有污染物夾雜其間?該污染物會有何作用?(四)評估及統計方法:所研究的疾病是否有預定目標或量化指標可以評估其療程的進度?(五)追蹤及監測計畫:上述測量方法是否會作病人病情追蹤之用?如何監測病人的療效?分析的敏感度如何?追蹤研究應每隔多久做一次?追蹤研究要持續多久?五、預期試驗效果:(一)進行此種治療可能會有那些效益與不良後果?如何防止或治療這些不良後果?此病若不使用體細胞療法,其後果的嚴重性和經治療而產生不良反應做比較,暗者孰輕孰重?如病人經體細胞治療後死亡,遺體應做何種研究?(二)公共衛生與風險評
《体细胞治疗人体试验申请与操作规范.》由会员jiups****uk12分享,可在线阅读,更多相关《体细胞治疗人体试验申请与操作规范.》请在金锄头文库上搜索。

建立安全生产长效机制-共创和谐平安输气管道

土石方爆破工程设计方案

康师傅百货商场制度汇编之退换货管理办法

庙头中学2012年中考百日誓师大会学生代表发言稿

围堰拆除爆破工程

华能洱源马鞍山风电场工程土石方爆破管理制度

国资委:全面开展管理提升活动-为培育世界一流企业奠定坚实基础

《专业技术人员职业发展与规划》电子书

应收票据审计方案
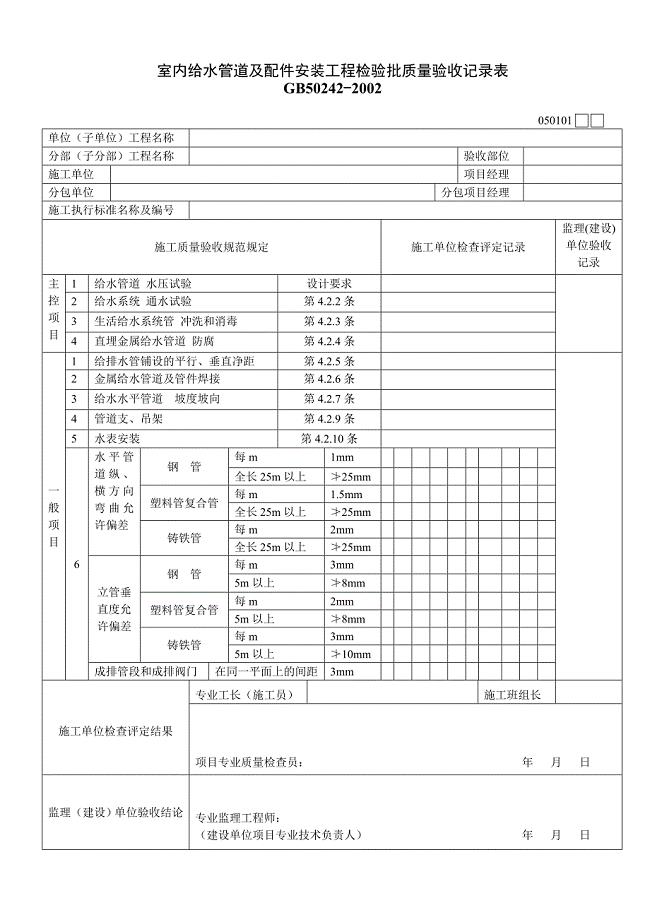
建筑给水排水与采暖工程质量验收用表

广播电视管理条例行政处罚裁量标准

广东电力系统调度运行操作管理规定

建筑给排水工程名词解释

幼儿园小班安全健康活动教案:宝宝误食后的急救

建业集团房屋建筑工程交房标准内容技术交底

建筑心理学论文(1)

康师傅百货商场制度汇编之工服管理程序009

建筑工程专业一级建造师继续教育培训结业报告20

廉洁风险防控回头看工作汇报材料

平台工作人员服务规范
 小数数学题:简便计算11道练习题及参考答案A10
小数数学题:简便计算11道练习题及参考答案A10
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A7
小数数学题:简便计算11道练习题及参考答案A7
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A3
小数数学题:简便计算11道练习题及参考答案A3
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A5
小数数学题:简便计算11道练习题及参考答案A5
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A9
小数数学题:简便计算11道练习题及参考答案A9
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A6
小数数学题:简便计算11道练习题及参考答案A6
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A8
小数数学题:简便计算11道练习题及参考答案A8
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A1
小数数学题:简便计算11道练习题及参考答案A1
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A4
小数数学题:简便计算11道练习题及参考答案A4
2024-04-17 2页
 小数数学题:简便计算11道练习题及参考答案A2
小数数学题:简便计算11道练习题及参考答案A2
2024-04-17 2页

